- токсичність [ правити | правити код ]
- Допомога при отруєнні оксидом вуглецю (II) [ правити | правити код ]
- Захист від оксиду вуглецю (II) [ правити | правити код ]
- Ендогенний монооксид вуглецю [ правити | правити код ]
- Промисловий спосіб [ правити | правити код ]
- Лабораторний спосіб [ правити | правити код ]
- Оксид вуглецю (II) в космічному просторі [ правити | правити код ]
монооксид вуглецю 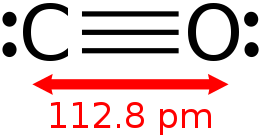
 систематичне
систематичне
найменування монооксид вуглецю Хім. формула CO стан безбарвний газ молярна маса 28,01 г / моль щільність 0,001250 ° C; 0,814-195 ° C г / см³ енергія іонізації 14,01 ± 0,01 еВ [2] Т. плав. -205 ° C Т. кип. -191,5 ° C Пр. взрв. 12,5 ± 0,1 об.% [2] ентальпія освіти -110,52 кДж / моль Тиск пара 35 ± 1 атм [2] розчинність в воді 0,0026 г / 100 мл Реєстр. номер CAS 630-08-0 PubChem 281 Реєстр. номер EINECS 211-128-3 SMILES InChI Реєстр. номер EC 006-001-00-2 RTECS FG3500000 ChEBI 17245 номер ООН 1016 ChemSpider 275 токсичність
Високотоксичний, СДОР 

![NFPA 704 [1]](/wp-content/uploads/2020/01/uk-monooksid-vuglecu-5.png) NFPA 704 [1]
NFPA 704 [1]
Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Монооксид вуглецю (чадний газ, окис вуглецю, оксид вуглецю (II)) - безбарвний надзвичайно токсичний газ без смаку і запаху, легший за повітря (при нормальних умовах). Хімічна формула - CO.
Молекула CO має потрійну зв'язок , Як і молекула азоту N2. Так як ці молекули подібні за будовою (ізоелектронними, двоатомний, мають близьку молярну масу), то і властивості їх також схожі - дуже низькі температури плавлення і кипіння, близькі значення стандартних ентропій і т.п.
У рамках методу валентних зв'язків будова молекули CO можна описати формулою ": C≡O:".
згідно методу молекулярних орбіталей електронна конфігурація збудженому молекули CO σ 2
O σ 2
z π 4
x, y σ 2
C. Потрійна зв'язок утворена σ -зв'язком, утвореної за рахунок σ z електронної пари , А електрони двічі виродженого рівня π x, y відповідають двом π-зв'язок. Електрони на несвязивающіх σC орбіталі і σO орбіталі відповідають двом електронним парам, одна з яких локалізована у атома вуглецю , Інша - у атома кисню .
Завдяки наявності потрійний зв'язку молекула CO досить міцна (енергія дисоціації 1 069 кДж / моль, або 256 ккал / моль, що більше, ніж у будь-яких інших двохатомних молекул) і має мале меж'ядерних відстань (D C≡O = 0,1128 нм або 1,13 Å).
Молекула слабо поляризована, її електричний дипольний момент μ = 0,04⋅10-29 Кл · м. Численні дослідження показали, що негативний заряд в молекулі CO зосереджений на атомі вуглецю C- ← O + (напрямок дипольного моменту в молекулі протилежно передбачалося раніше). Енергія іонізації 14,0 еВ, силова константа зв'язку k = 18,6.
Оксид вуглецю (II) являє собою безбарвний газ без смаку і запаху. Горючий. Так званий «запах чадного газу» насправді являє собою запах органічних домішок.
Основними типами хімічних реакцій, в яких бере участь оксид вуглецю (II), є реакції приєднання і окислювально-відновні реакції , В яких він проявляє відновні властивості.
При кімнатних температурах CO малоактивний, його хімічна активність значно підвищується при нагріванні і в розчинах. Так, в розчинах він відновлює солі Au , Pt , Pd та інших до металів вже при кімнатній температурі. При нагріванні відновлює і інші метали, наприклад CO + CuO → Cu + CO2 ↑. Це широко використовується в пирометаллургии . На реакції CO в розчині з хлоридом паладію заснований спосіб якісного виявлення CO, див. нижче.
Окислення СО в розчині часто йде з помітною швидкістю лише в присутності каталізатора. При підборі останнього основну роль грає природа окислювача. так, KMnO4 швидше за все окисляє СО в присутності мелкораздробленного срібла , K2Cr2O7 - в присутності солей ртуті , KClO3 - в присутності OsO4. Загалом, за своїми відновлювальних властивостей СО схожий на молекулярний водень.
Нижче 830 ° C сильнішим відновником є CO, - вище - водень. Тому рівновага реакції
H 2 O + C O ⇄ C O 2 + H 2 {\ displaystyle {\ mathsf {H_ {2} O + CO \ rightleftarrows CO_ {2} + H_ {2}}}}
до 830 ° C зміщене вправо, вище 830 ° C вліво.
Цікаво, що існують бактерії, здатні за рахунок окислення СО отримувати необхідну їм для життя енергію.
Оксид вуглецю (II) горить полум'ям синього кольору [3] (Температура початку реакції 700 ° C) на повітрі:
2 C O + O 2 → 2 C O 2 {\ displaystyle {\ mathsf {2CO + O_ {2} \ rightarrow 2CO_ {2}}}} (Δ G ° 298 = -257 кДж, Δ S ° 298 = -86 Дж / K).
Температура горіння CO може досягати 2100 ° C. Реакція горіння є ланцюгової, причому ініціаторами служать невеликі кількості водородсодержащих з'єднань (вода, аміак , сірководень та ін.)
Завдяки такій хорошій теплотворної здатності, CO є компонентом різних технічних газових сумішей (див., Наприклад генераторний газ ), Що використовуються, в тому числі, для опалення. У суміші з повітрям вибухонебезпечний; нижній і верхній концентраційні межі поширення полум'я: від 12,5 до 74% (за обсягом) [4] .
Оксид вуглецю (II) реагує з галогенами . Найбільше практичне застосування отримала реакція з хлором :
C O + C l 2 → h ν C O C l 2. {\ Displaystyle {\ mathsf {CO + Cl_ {2} {\ xrightarrow {h \ nu}} COCl_ {2}}}.}
Реакція екзотермічна, її тепловий ефект 113 кДж, в присутності каталізатора ( активоване вугілля ) Вона йде вже при кімнатній температурі. В результаті реакції утворюється фосген - речовина, що отримало широке розповсюдження в різних галузях хімії (а також як бойова отруйна речовина ). З аналогічних реакції можуть бути отримані COF2 ( карбонілфторід ) І COBr2 ( карбонілбромід ). Карбоніліодід не отримана. Екзотермічність реакцій швидко знижується від F до I (Для реакцій з F2 парниковий ефект 481 кДж, з Br2 - 4 кДж). Можна також отримувати і змішані похідні, наприклад COFCl (докладніше див. галогенпохідних вугільної кислоти ).
Реакцією CO з F2, крім карбонілфторіда COF2, можна отримати перекисне з'єднання (FCO) 2O2. Його характеристики: температура плавлення -42 ° C, кипіння +16 ° C, володіє характерним запахом (схожим на запах озону ), При нагріванні вище 200 ° C розкладається з вибухом (продукти реакції CO2, O2 і COF2), в кислому середовищі реагує з йодидом калію за рівнянням:
(F C O) 2 O 2 + 2 K I → 2 K F + I 2 + 2 C O 2. {\ Displaystyle {\ mathsf {(FCO) _ {2} O_ {2} + 2KI \ rightarrow 2KF + I_ {2} + 2CO_ {2}.}}}
Оксид вуглецю (II) реагує з халькогенами . З сірої утворює сероксід вуглецю COS, реакція йде при нагріванні, з рівняння:
C O + S → C O S {\ displaystyle {\ mathsf {CO + S \ rightarrow COS}}} (Δ G ° 298 = -229 кДж, Δ S ° 298 = -134 Дж / K).
Отримано також аналогічні селеноксід вуглецю COSe і теллуроксід вуглецю COTe.
Відновлює SO2:
2 C O + S O 2 → 2 C O 2 + S. {\ Displaystyle {\ mathsf {2CO + SO_ {2} \ rightarrow 2CO_ {2} + S.}}}
C перехідними металами утворює горючі і отруйні сполуки - карбоніли , Такі як [Fe (CO) 5], [Cr (CO) 6], [Ni (CO) 4], [Mn2 (CO) 10], [Co2 (CO) 9] та ін. Деякі з них леткі.
n C O + M e → [M e (C O) n] {\ displaystyle {\ mathsf {nCO + Me \ rightarrow [Me (CO) _ {n}]}}}
Оксид вуглецю (II) незначно розчиняється в воді, проте не реагує з нею. Також він не вступає в реакції з розчинами лугів і кислот . Однак реагує з розплавами лугів з утворенням відповідних формиатов :
C O + K O H → H C O O K. {\ Displaystyle {\ mathsf {CO + KOH \ rightarrow HCOOK.}}}
Цікава реакція оксиду вуглецю (II) з металевим калієм в аміачних розчинах. При цьому утворюється вибухова з'єднання діоксодікарбонат калію :
2 K + 2 C O → K 2 C 2 O 2. {\ Displaystyle {\ mathsf {2K + 2CO \ rightarrow K_ {2} C_ {2} O_ {2}.}}}
реакцією з аміаком при високих температурах можна отримати важливе для промисловості з'єднання - ціановодород HCN. Реакція йде в присутності каталізатора ( діоксид торію ThO2) за рівнянням:
C O + N H 3 → H 2 O + H C N. {\ Displaystyle {\ mathsf {CO + NH_ {3} \ rightarrow H_ {2} O + HCN.}}}
Найважливішим властивістю оксиду вуглецю (II) є його здатність реагувати з воднем з утворенням органічних сполук ( процес синтезу Фішера - Тропша ):
x C O + y H 2 → {\ displaystyle {\ mathsf {xCO + yH_ {2} \ rightarrow}}} спирти + лінійні алкани.
Цей процес є джерелом виробництва таких найважливіших промислових продуктів як метанол , Синтетичне дизельне паливо, багатоатомні спирти, масла і мастила.
токсичність [ правити | правити код ]
Чадний газ дуже токсичний.
TLV (Гранична гранична концентрація, США): 25 ppm ; 29 мг / м³ (як TWA - середньозмінна концентрація, США) (ACGIH 1994-1995). MAC (максимальна допустима концентрація, США): 30 ppm; 33 мг / м³; Вагітність: B (шкідливий ефект імовірний навіть на рівні MAK) (1993). ГДК р.з. по Гігієнічним нормативам ГН 2.2.5.1313-03 становить 20 мг / м³ (близько 0,0017%).
У вихлопі бензинового автомобіля допускається до 1,5-3% (допустима концентрація сильно розрізняється залежно від країни / застосовуваних стандартів; а 3% - багато навіть для старого карбюраторного автомобіля без каталізатора).
за класифікацією ООН оксид вуглецю (II) відноситься до класу небезпеки 2,3, вторинна небезпека за класифікацією ООН: 2,1.
Чадний газ дуже небезпечний, так як не має запаху і викликає отруєння і навіть смерть . [5] Ознаки отруєння: головний біль і запаморочення ; відзначається шум у вухах, задишка, прискорене серцебиття, мерехтіння перед очима, почервоніння обличчя, загальна слабкість, нудота, іноді блювота; у важких випадках судоми, втрата свідомості , кома [6] [3] .
Токсична дія оксиду вуглецю (II) обумовлено утворенням карбоксигемоглобина - значно більш міцного карбонильного комплексу з гемоглобіном , В порівнянні з комплексом гемоглобіну з киснем (оксигемоглобіном) [6] . Таким чином, блокуються процеси транспортування кисню і клітинного дихання . Концентрація в повітрі більше 0,1% призводить до смерті протягом однієї години [6] .
Досліди на молодих щурах показали, що концентрація CO в повітрі 0,02% уповільнює їхній ріст і знижує активність в порівнянні з контрольною групою.
Допомога при отруєнні оксидом вуглецю (II) [ правити | правити код ]
З'єднання окису вуглецю з гемоглобіном можна зупинити. При отруєнні рекомендуються такі дії [6] :
Світовій медицині невідомі надійні антидоти для застосування в разі отруєння чадним газом [7] .
Захист від оксиду вуглецю (II) [ правити | правити код ]
CO дуже слабо поглинається активованим вугіллям звичайних фільтруючих протигазів , Тому для захисту від нього застосовується спеціальний фільтруючий елемент (він може також підключатися додатково до основного) - гопкалітовий патрон. гопкаліт являє собою каталізатор , Що сприяє окисленню CO в CO2 при нормальних температурах. Недоліком використання гопкалита є те, що при його застосуванні доводиться вдихати нагріте в результаті реакції повітря. Звичайний спосіб захисту - використання ізолюючого дихального апарату [3] .
Ендогенний монооксид вуглецю [ правити | правити код ]
Ендогенний монооксид вуглецю виробляється в нормі клітинами організму людини і тварин і виконує функцію сигнальної молекули. Він відіграє певну фізіологічну роль в організмі, зокрема, є нейротрансмиттером і викликає вазодилатацию [8] . З огляду на ролі ендогенного чадного газу в організмі, порушення його метаболізму пов'язують з різними захворюваннями, такими, як нейродегенеративні захворювання, атеросклероз кровоносних судин , гіпертонічна хвороба , серцева недостатність , різні запальні процеси [8] .
Ендогенний чадний газ утворюється в організмі завдяки окисляє дії ферменту гемоксигенази на гем , Який є продуктом руйнування гемоглобіну і міоглобіну , А також інших гемосодержащіх білків. Цей процес викликає утворення в крові людини невеликої кількості карбоксигемоглобіну, навіть якщо людина не курить і дихає не атмосферне повітрям (Завжди містить невеликі кількості екзогенного чадного газу), а чистим киснем або сумішшю азоту з киснем.
Слідом за появою в 1993 році першими даними про те, що ендогенний чадний газ є нормальним нейротрансмиттером в організмі людини [9] [10] , А також одним з трьох ендогенних газів, які в нормі модулюють перебіг запальних реакцій в організмі (два інших - оксид азоту (II) і сірководень ), Ендогенний чадний газ привернув значну увагу клініцистів і дослідників як важливий біологічний регулятор. Було показано, що в багатьох тканинах все три вищезазначених газу є протизапальними речовинами, вазодилататорами , А також викликають ангіогенез [11] . Однак не все так просто і однозначно. Ангіогенез - не завжди корисний ефект, оскільки він, зокрема, відіграє роль в зростанні злоякісних пухлин, а також є однією з причин пошкодження сітківки при макулярної дегенерації. Зокрема, важливо відзначити, що куріння (основне джерело чадного газу в крові, що дає в кілька разів більшу концентрацію його, ніж природна продукція) підвищує ризик макулярної дегенерації сітківки в 4-6 разів.
Існує теорія про те, що в деяких синапсах нервових клітин, де відбувається довготривале запам'ятовування інформації, яка бере клітина у відповідь на прийнятий сигнал виробляє ендогенний чадний газ, який передає сигнал назад передавальної клітці, ніж повідомляє їй про свою готовність і надалі приймати сигнали від неї і підвищуючи активність клітини-передавача сигналу. Деякі з цих нервових клітин містять гуанілатциклазу, фермент, який активується при впливі ендогенного чадного газу [10] .
Дослідження, присвячені ролі ендогенного чадного газу як протизапального речовини і цитопротектора, проводилися в безлічі лабораторій по всьому світу. Ці властивості ендогенного чадного газу роблять вплив на його метаболізм цікавою терапевтичної мішенню для лікування таких різних патологічних станів, як пошкодження тканин, викликане ішемією і подальшої реперфузією (а це, наприклад, інфаркт міокарда , ішемічний інсульт ), Відторгнення трансплантата, атеросклероз судин, важкий сепсис , важка малярія , Аутоімунні захворювання. Проводилися в тому числі і клінічні випробування на людині, однак результати їх поки ще не опубліковані [12] .
Підсумовуючи, то, що відомо на 2015 рік про роль ендогенного чадного газу в організмі, можна викласти наступним чином [13] :
- Ендогенний чадний газ - одна з важливих ендогенних сигнальних молекул;
- Ендогенний чадний газ модулює функції ЦНС і серцево-судинної системи ;
- Ендогенний чадний газ пригнічує агрегацію тромбоцитів і їх адгезію до стінок судин;
- Вплив на обмін ендогенного чадного газу в майбутньому може бути однією з важливих терапевтичних стратегій при ряді захворювань.
Токсичність диму, що виділяється при горінні вугілля, була описана ще Аристотелем і Галеном .
Оксид вуглецю (II) був вперше отриманий французьким хіміком Жаком де Лассон в +1776 при нагріванні оксиду цинку з вугіллям, але спочатку його помилково прийняли за водень, так як він горів синім полум'ям.
Те, що до складу цього газу входить вуглець і кисень, з'ясував в 1800 англійський хімік Вільям Крюйкшенк . Токсичність газу була досліджена в 1846 році французьким медиком Клодом Бернаром в дослідах на собаках [14] .
Оксид вуглецю (II) поза атмосферою Землі вперше був виявлений бельгійським вченим М. Міжотом (M. Migeotte) в 1949 році за наявності основної колебательно-обертальної смуги в ІЧ-спектрі Сонця. Оксид вуглецю (II) в міжзоряному середовищі був виявлений в 1970 р [15]
Промисловий спосіб [ правити | правити код ]
2 C + O 2 → 2 C O {\ displaystyle {\ mathsf {2C + O_ {2} \ rightarrow 2CO}}} (Тепловий ефект цієї реакції 220 кДж), C O 2 + C ⇄ 2 C O {\ displaystyle {\ mathsf {CO_ {2} + C \ rightleftarrows 2CO}}}
(Δ H = 172 кДж, Δ S = 176 Дж / К)
Ця реакція відбувається при пічної топці, коли занадто рано закривають пічну заслінку (поки остаточно не прогоріли вугілля). Утворений при цьому оксид вуглецю (II) внаслідок своєї отруйності викликає фізіологічні розлади ( «чад») і навіть смерть (див. Нижче), звідси й одне з тривіальних назв - «чадний газ» [3] .
Реакція відновлення діоксиду вуглецю оборотна, вплив температури на стан рівноваги цієї реакції наведено на графіку. Перебіг реакції вправо забезпечує ентропійний фактор, а вліво - ентальпійного. При температурі нижче 400 ° C рівновагу практично повністю зрушено вліво, а при температурі понад 1000 ° C вправо (в сторону освіти CO). При низьких температурах швидкість цієї реакції дуже мала, тому оксид вуглецю (II) при нормальних умовах досить стійкий. Ця рівновага носить спеціальну назву рівновагу будуар.
Лабораторний спосіб [ правити | правити код ]
H C O O H → H 2 S O 4 o t H 2 O + C O. {\ Displaystyle {\ mathsf {HCOOH {\ xrightarrow [{H_ {2} SO_ {4}}] {^ {o} t}} H_ {2} O + CO.}}} Можна також обробити мурашину кислоту хлорсульфоновой . Ця реакція йде вже при звичайній температурі за схемою: H C O O H + C l S O 3 H → H 2 S O 4 + H C l + C O ↑. {\ Displaystyle {\ mathsf {HCOOH + ClSO_ {3} H \ rightarrow H_ {2} SO_ {4} + HCl + CO \ uparrow.}}}
H 2 C 2 O 4 → H 2 S O 4 o t C O ↑ + C O 2 ↑ + H 2 O. {\ Displaystyle {\ mathsf {H_ {2} C_ {2} O_ {4} {\ xrightarrow [{H_ {2} SO_ {4}}] {^ {o} t}} CO \ uparrow + CO_ {2} \ uparrow + H_ {2} O.}}}
K 4 [F e (C N) 6] + 6 H 2 S O 4 + 6 H 2 O → o t 2 K 2 S O 4 + F e S O 4 + 3 (N H 4) 2 S O 4 + 6 C O ↑. {\ Displaystyle {\ mathsf {K_ {4} [Fe (CN) _ {6}] + 6H_ {2} SO_ {4} + 6H_ {2} O {\ xrightarrow [{}] {^ {o} t} } 2K_ {2} SO_ {4} + FeSO_ {4} +3 (NH_ {4}) _ {2} SO_ {4} + 6CO \ uparrow.}}}
M g + Z n C O 3 → o t M g O + Z n O + C O ↑. {\ Displaystyle {\ mathsf {Mg + ZnCO_ {3} {\ xrightarrow [{}] {^ {o} t}} MgO + ZnO + CO \ uparrow.}}}
Якісно можна визначити наявність CO по потемніння розчинів хлориду паладію (Або просоченої цим розчином паперу). Потемененіе пов'язано з виділенням дрібнодисперсного металічного паладію за схемою:
P d C l 2 + C O + H 2 O → P d ↓ + C O 2 + 2 H C l. {\ Displaystyle {\ mathsf {PdCl_ {2} + CO + H_ {2} O \ rightarrow Pd \ downarrow + CO_ {2} + 2HCl.}}}
Ця реакція дуже чутлива. Стандартний розчин: 1 грам хлориду паладію на літр води.
Кількісне визначення оксиду вуглецю (II) засновано на Іодометріческій реакції:
5 C O + I 2 O 5 → 5 C O 2 + I 2. {\ Displaystyle {\ mathsf {5CO + I_ {2} O_ {5} \ rightarrow 5CO_ {2} + I_ {2}.}}}
- Оксид вуглецю (II) є проміжним реагентом, використовуваним в реакціях з воднем в найважливіших промислових процесах для отримання органічних спиртів і нерозгалужених вуглеводнів.
- Оксид вуглецю (II) застосовується для обробки м'яса тварин і риби, надає їм яскраво-червоний колір і вид свіжості, не змінюючи смаку (технології Clear smoke [En] і Tasteless smoke [En] ). Допустима концентрація CO дорівнює 200 мг / кг м'яса.
- Оксид вуглецю (II) є основним компонентом генераторного газу , Що використовувався в якості палива в газогенераторних автомобілях .
- Чадний газ від вихлопу двигунів застосовувався нацистами в роки Другої світової війни для масового умертвіння людей шляхом отруєння.
Розрізняють природні і антропогенні джерела надходження в атмосферу Землі . У природних умовах, на поверхні Землі, CO утворюється при неповному анаеробному розкладанні органічних сполук і при згорянні біомаси, в основному в ході лісових і степових пожеж. Оксид вуглецю (II) утворюється в грунті як біологічним шляхом (виділення живими організмами), так і синтетичним. Експериментально доведено виділення оксиду вуглецю (II) за рахунок звичайних в грунтах фенольних сполук, що містять групи OCH3 або OH в орто- або пара-положеннях по відношенню до першої гідроксильної групі.
Загальний баланс продукування небіологічного CO і його окислення мікроорганізмами залежить від конкретних екологічних умов, в першу чергу від вологості і значення pH . Наприклад, з аридних грунтів оксид вуглецю (II) виділяється безпосередньо в атмосферу, створюючи таким чином локальні максимуми концентрації цього газу.
В атмосфері СО є продуктом ланцюжків реакцій за участю метану та інших вуглеводнів (в першу чергу, ізопрену).
Основних антропогенних Джерелом CO в Сейчас годину службовців віхлопні гази двигунів внутрішнього згоряння . Оксид вуглецю утворюється при згорянні вуглеводневого палива в двигунах внутрішнього згоряння при недостатніх температурах або поганий налаштування системи подачі повітря (подається недостатня кількість кисню для окислення CO в CO2). У минулому значну частку антропогенного надходження CO в атмосферу забезпечував світільній газ , Який використовували для освітлення приміщень в XIX столітті . За складом він приблизно відповідав водяному газу , Тобто містив до 45% оксиду вуглецю (II). У комунальній сфері не застосовується в зв'язку з наявністю значно більш дешевого та енергоефективного аналога - природного газу .
Надходження CO від природних і антропогенних джерел приблизно однаково.
Оксид вуглецю (II) в атмосфері знаходиться в швидкому кругообігу: середній час його перебування складає близько 0,1 року. Основний канал втрати CO - окислення гідроксилом до діоксиду вуглецю.
Оксид вуглецю (II) в космічному просторі [ правити | правити код ]
Оксид вуглецю (II) - друга за поширеністю (після H2) молекула в міжзоряному середовищі [15] . Цей газ відіграє важливу роль в еволюції молекулярних газових хмар , В яких відбувається активне зореутворення . Як і інші молекули, CO випромінює ряд інфрачервоних ліній, що виникають при переходах між обертальними рівнями молекули; ці рівні порушуються вже при температурах в декілька десятків коливань. Концентрація CO в міжзоряному середовіщі досить мала, щоб (на відміну від набагато більш поширеною молекули H2) випромінювання в молекулярних обертальних лініях не відчувало сильного самопоглинання в хмарі. Таким чином енергія майже безперешкодно йде з хмари, яке остигає і стискається, запускаючи механізм зореутворення . У найбільш щільних хмарах, де самопоглинання в лініях CO виявляється значним, стає помітною втрата енергії в лініях рідкого ізотопного аналога 13CO (відносна ізотопна поширеність 13C - близько 1%). У зв'язку з його більш сильним випромінюванням, в порівнянні з атомарним воднем, оксид вуглецю (II) використовується для пошуку подібних газових скупчень. У лютому 2012 року астрономи з використанням європейського космічного телескопа «Планк» склали найбільш повну карту його розподілу по небесній сфері [16] .
- ↑ Carbon Monoxide | Cameo Chemicals | Noaa
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0105.html
- ↑ 1 2 3 4 оксид вуглецю (неопр.). Російська енциклопедія з охорони праці: В 3 тт. - 2-е изд., Перераб. и доп. - М .: Изд-во НЦ ЕНАС, 2007. Дата обігу 5 червня 2012. Читальний зал 22 липня 2012 р.
- ↑ Баратов А. Н. вогнестійкість і засоби їх гасіння: Довідкове видання: в 2-х книгах. - М.: Хімія, 1990. - Т. Книга 2. - С. 384.
- ↑ Рощин А.В., Томілін В.В., Штернберг Е.Я. Окис вуглецю // Велика медична енциклопедія : В 30 т. / Гл. ред. Б.В. Петровський . - 3 вид. - Москва : Радянська енциклопедія , 1981. - Т. 17. Ніландера проба - остеопатія . - 512 с. - 150 800 прим.
- ↑ 1 2 3 4 Довідник фельдшера, під ред. А. Н. Шабанова. - М .: «Медицина», 1984.
- ↑ Scientists hunt for carbon monoxide poisoning antidote (Англ.), Associated Press (Dec 09, 2016). Дата звернення 29 вересня 2018. «we do not have antidotes for carbon monoxide poisoning, and it's the most common poisoning».
- ↑ 1 2 Wu, L; Wang, R (December 2005). "Carbon Monoxide: Endogenous Production, Physiological Functions, and Pharmacological Applications". Pharmacol Rev. 57 (4): 585-630. DOI : 10.1124 / pr.57.4.3 . PMID 16382109 .
- ↑ Verma, A; Hirsch, D .; Glatt, C .; Ronnett, G .; Snyder, S. (1993). "Carbon monoxide: A putative neural messenger". Science. 259 (5093): 381-4. Bibcode : 1993Sci ... 259..381V . DOI : 10.1126 / science.7678352 . PMID 7678352 .
- ↑ 1 2 Kolata, Gina. Carbon Monoxide Gas Is Used by Brain Cells As a Neurotransmitter (January 26, 1993). Дата обігу 2 червня 2010.
- ↑ Li, L; Hsu, A; Moore, PK (2009). "Actions and interactions of nitric oxide, carbon monoxide and hydrogen sulphide in the cardiovascular system and in inflammation-a tale of three gases!". Pharmacology & therapeutics. 123 (3): 386-400. DOI : 10.1016 / j.pharmthera.2009.05.005 . PMID 19486912 .
- ↑ Johnson, Carolyn Y.. Poison gas may carry a medical benefit (October 16, 2009). Дата звернення 16 жовтня 2009.
- ↑ Olas, Beata (25 April 2014 року). "Carbon monoxide is not always a poison gas for human organism: Physiological and pharmacological features of CO" . Chemico-Biological Interactions. 222 (5 October 2014 року): 37-43. DOI : 10.1016 / j.cbi.2014.08.005 .
- ↑ Rosemary H. Waring, Glyn B. Steventon, Steve C. Mitchell. Molecules of death . - Imperial College Press, 2007. - P. 38. - ISBN 1-86094-814-6 .
- ↑ 1 2 Combes, Françoise (1991). "Distribution of CO in the Milky Way". Annual Review of Astronomy & Astrophysics. 29: 195. Bibcode : 1991ARA & A..29..195C . DOI : 10.1146 / annurev.aa.29.090191.001211 .
- ↑ «Планк» склав карту чадного газу в Галактиці ( Лента.ру ).
- Ахметов Н. С. Загальна та Неорганічна хімія. 5-е изд., Испр. - М .: Вища. шк .; 2003 ISBN 5-06-003363-5
- Некрасов Б. В. Основи Загальної хімії. Т. I, изд. 3-е, испр. и доп. Вид-во «Хімія», 1973 г. Стор. 495-497, 511-513
- Хімія: Справ. з. / В. Шретер, К.-Х. Лаутеншлегер, Х. Бібрак і ін .: Перс. з нім. 2-е изд., Стереотип. - М.: Хімія, 2000. ISBN 5-7245-0360-3 (Рос.)
- Баратов А. Н. вогнестійкість і засоби їх гасіння: Довідкове видання: в 2-х книгах; Книга 2. - М .: Хімія, 1990. - 384с.













