- У промисловості [ правити | правити код ]
- Лабораторний синтез [ правити | правити код ]
- Повний синтез [ правити | правити код ]
Лимонна кислота 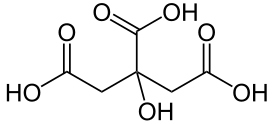
({{{Картинка}}})  ({{{Картінка3D}}}) систематичне
({{{Картінка3D}}}) систематичне
найменування 2 гідроксіпропан- 1,2,3- трикарбонових кислот Традиційні назви Лимонна кислота Хім. формула (HOOCCH2) 2C (OH) COOH молярна маса 192,1 г / моль густина 1,665 г / см³ Температура • плавлення 153 ° C • розкладання 175 ° C Константа дисоціації кислоти p K a {\ displaystyle pK_ {a}} 3,14 [1] розчинність • в воді 133 г / 100 мл Реєстр. номер CAS 77-92-9 PubChem 311 Реєстр. номер EINECS 201-069-1 SMILES InChI Кодекс Аліментаріус E330 RTECS GE7350000 ChEBI 30769 номер ООН 1789 ChemSpider 305 Короткі характер. небезпеки (H) Заходи предостор. (P) P264, P280, P305 + P351 + P338, P337 + P313 сигнальне слово обережно піктограми СГС
 NFPA 704 Наведено дані для стандартних умов (25 ° C, 100 кПа), якщо не вказано інше.
NFPA 704 Наведено дані для стандартних умов (25 ° C, 100 кПа), якщо не вказано інше.  Медіафайли на Вікісховища
Медіафайли на Вікісховища
Лимонна кислота (2-гідроксіпропан-1,2,3-трикарбонових кислот, 3-гідрокси-3-карбоксіпентандіовая) HOOC-CH2-C (OH) COOH-CH2-COOH або (НООССН2) 2С (ОН) СООН - трёхосновная карбонова кислота .
Кристалічна речовина білого кольору, температура плавлення 153 ° C . Добре розчинна у воді , Розчинна в етиловому спирті , Малорастворима в діетиловому ефірі . Є слабкою кислотою. солі та складні ефіри лимонної кислоти називають цитратами .
Відкриття лимонної кислоти приписують арабському алхімікові Джабіру ібн Хайянь . Виділити її вперше вдалося шведському аптекаря Карлу Шеєле . В 1784 році він осадив її у вигляді цитрату кальцію з лимонного соку.
У 1838 році Юстус фон Лібіх встановив, що в молекулі лимонної кислоти присутній одна гідроксильна група і три карбоксильні групи . Власне лимонна кислота в чистому вигляді була отримана з цитрату кальцію в 1860 році в Англії [2] [3] .
Лимонна кислота являє собою кристалічну речовину без кольору і запаху, що має сильний кислий смак. Нижче 36,6 ° С вона кристалізується з водного розчину в вигляді моногідрату , котрий має густина 1,542 г / см3 і плавиться при 100 ° С. Його кристали мають орторомбические сингонії . Безвода лимонна кислота має відносну щільність 1,665 г / см3і плавиться при 153 ° С.
Моногидрат кристалізується в моноклінної сингонії . Перекласти моногідрат в безводну форму можна в вакуумі в присутності сірчаної кислоти . У безводному вигляді гігроскопічна і поглинає вологу з повітря [4] .
При нагріванні вище 175 ° C лимонна кислота переходить в аконітову кислоту , А при сухий перегонці отщепляется вода і декарбоксилируется , Одночасному утворюючи ацетон , І дає ангідриди ітаконовою і цітраконовой кислот. окислення перманганатом калію при 35 ° С призводить до ацетондікарбоновой кислоті , А при 85 ° С - до щавлевої кислоти . При плавленні з гідроксидом калію лимонна кислота утворює щавлеву кислоту і оцтову кислоту [5] .
Лимонна кислота є слабкою трёхосновной кислотою, утворює три ряди солей, в розчині піддається багатоступеневою електролітичноїдисоціації . константи дисоціації (У воді при 18 ° C) рівні:
К1 = 8,2⋅10-4; K2 = 1,8⋅10-5; K3 = 4,0⋅10-6 [4] .
У водному розчині лимонна кислота утворює хелатні комплекси з іонами кальцію , магнію , міді , заліза і іншими. Іноді в комплексообразовании бере участь не одна молекула лимонної кислоти [5] .
Лимонна кислота утворює складні ефіри зі спиртами в присутності звичайних кислотних каталізаторів ( сірчана кислота , пара -толуолсульфокіслота , іонообмінні смоли ) Або без каталізатора (з висококиплячих спиртами). Деякі ефіри, наприклад, Тріметілцітрат , триетилцитрат і трібутілцітрат використовуються в якості пластифікаторів . З двохатомними і багатоатомних спиртами лимонна кислота утворює поліефіри [6] .
Гідроксильна група лимонної кислоти при обробці хлорангидридами органічних кислот і ангідридами кислот може брати участь в утворенні складних ефірів, а також взаємодіє з епоксидами [6] .
Лимонна кислота під дією УФ починає випускати слабке зелене свічення протягом короткого проміжку часу [ Джерело не вказано 189 днів ].
У промисловості [ правити | правити код ]
З середини 1800-х рр. лимонну кислоту отримували виключно з соку недозрілих лимонів , Змішуючи його з негашеного вапном і облягаючи таким чином плохорастворімий цитрат кальцію . Обробка цитрату кальцію сірчаною кислотою призводить до утворення осаду сульфату кальцію, а з надосадової рідини кристалізацією виділяли лимонну кислоту. Вихід такого процесу становив 2-3 мас. % Від маси фруктів [6] . В літературі згадується, що лимонну кислоту у вигляді кальцієвої солі розвозили з Сицилії і Південної Італії до місць споживання (переважно в Англію , Францію і США ), А саму кислоту виділяли вже на місці [7] .
У 1893 році був виявлений перший ферментативний метод отримання лимонної кислоти: німецький хімік і мікології Карл Вемер використовував для цього плісняві гриби роду пеницилл . Однак впровадити метод в промисловість не вдавалося через проблеми з очищенням продукту. Успіх був досягнутий лише в 1919 році, коли ферментативний процес був організований в Бельгії . Перевага на користь ферментативного отримання стався після Першої світової війни , Коли виникли проблеми з постачанням лимонної кислоти з Італії, а світові потреби все більш наростали. У 1923 році фірма Пфайзер комерціалізувала відкритий раніше Джеймсом Каррі і Чарлзом Том процес перетворення вуглеводів в лимонну кислоту під дією цвілевих грибів виду Aspergillus niger в присутності невеликої кількості неорганічних солей [7] .
Станом на початок ХХІ ст. весь обсяг промислової лимонної кислоти виробляється біосинтезу . В якості сировини використовують гідролізат кукурудзи (в Північній і Південній Америці і Європі ), Гідролізат маніока , батата і кукурудзи (в Азії ), Кристалічну сахарозу (В Південній Америці) і мелясу (В Азії і Європі). У деяких випадках лимонну кислоту отримують з сільськогосподарських відходів [6] .
Цей процес використовується з 1930-х рр. Теоретично, з 100 кг сахарози можна отримати 123 кг моногідрату лимонної кислоти або 112 кг безводної лимонної кислоти. Фактично вихід нижче так як грибки споживають частину сахарози для власного зростання і дихання. Реальний вихід становить від 60 до 85% від теоретичного. Ферментативний процес можна проводити в трьох форматах:
- твердофазная ферментація;
- поверхнева ферментація;
- глибинна ферментація [8] .
При твердофазной ферментації сировину поміщається в жолоби і змочується водою. При необхідності в воду додають поживні речовини, і потім туди поміщають грибкову культуру. Після закінчення процесу лимонну кислоту вимивають водою, виділяють з розчину і очищають.
Поверхневу ферментацію проводять на спеціальних лотках, куди поміщають субстрат і деякі неорганічні поживні речовини. pH середовища регулюють в діапазоні 3-7 pH в залежності від виду субстрату, потім проводять стерилізацію і встановлюють необхідну температуру. Потім на лотки наносять культуру грибків, які розмножується і покриває всю поверхню субстрату, після чого починається утворення лимонної кислоти. Після закінчення процесу з рідини виділяють лимонну кислоту.
Глибинна ферментація проводиться в великих ємностях в два етапи. Спочатку 10% субстрату ферментують протягом 1 дня в якості затравки, після чого суміш додають в основну масу і ферментують протягом 3-7 днів. Процес проводиться при постійній продувки рідини повітрям за допомогою компресора [8] .
Після ферментації рідина фільтрують через мембрану і відокремлюють лимонну кислоту від білків і залишкових вуглеводів негашеного вапном, екстракцією або хроматографією. По першому, найбільш поширеній способу, лимонна кислота осідає у вигляді кальцієвої солі, яку потім обробляють сірчаної кислотою, отримуючи нерозчинний гіпс і розчин очищеної лимонної кислоти. Другий спосіб заснований на використанні специфічного розчинника, в якому лимонна кислота розчиняється краще, ніж домішки.
Хроматографічна очищення заснована на використанні анионитов : Лимонна кислота сорбируется на носії, а потім вимивається з сорбенту розбавленою сірчаною кислотою [9] .
Після виділення проводять очистку. Для цього забруднену лимонну кислоту обробляють активованим вугіллям для видалення забарвлених домішок, пропускають через шар іонообмінних смол для видалення розчинних солей, фільтрують від нерозчинних домішок і кристалізують [8] .
У 2012 році світовий обсяг виробництва лимонної кислоти становив приблизно 1,6 млн тонн, з них приблизно 0,8-0,9 млн тонн вироблено в Китаї. Близько 70% від загального виробництва використовується в харчової промисловості [8] .
Лабораторний синтез [ правити | правити код ]
У класичний лабораторному синтезі лимонної кислоти в якості вихідної речовини застосовують ацетон , Котрий броміруют по метильних групам, потім проводять реакцію з ціановодорода і гидролизуют [6] .
Повний синтез [ правити | правити код ]
Вперше лимонну кислоту хімічним синтезом отримали Грімо (Grimaux) і Адам (Adam) в 1880 році. Вихідним з'єднанням в цьому синтезі послужив гліцерин . первинні гідроксильні групи молекули гліцерину спочатку заміняли на атоми хлору , А потім на Нітрільниє групи , Які при гідролізі давали кінцеві карбоксильні групи . Вторинну ж гідроксильну групу окисляли до кетогрупи , До якої потім приєднували ціановодород; отриманий ціангідрін також при гідролізі давав карбоксильну групу [10] .
Інший підхід був запропонований в 1890 році. Він був заснований на перетворенні ацетооцтового ефіру , Який хлорували, як передбачалося, по кінцевого α-положенню, потім вводили в той же стан нітрильну групу, яку в підсумку гідролізували до карбоксильної групи. На останній стадії створювали заступники при атомі С2, отримуючи ціангідрін і гидролизуя його в кислому середовищі. Схема цього повного синтезу була поставлена під сумнів: деякі хіміки, наприклад, Шарль Прево , Висловили припущення, що хлорується НЕ кінцеве α-положення ацетооцтового ефіру, а середнє, через що утворюється не сама лимонна кислота, а її ізомер. Дискусія, як передбачається, виник через те, що в кінці XIX ст. ще не існувало спектроскопических методів, які дозволили б помітити цю різницю [11] .
У 1891 році лимонну кислоту отримали приєднанням синильної кислоти до моноетиловий ефіру ацетондікарбоновой кислоти з подальшим гідролізом. Правда, саме вихідна речовина було спочатку отримано з лимонної кислоти [12] .
У 1897 році був запропонований підхід до синтезу лимонної кислоти, заснований на недавно відкритій реакції Реформатського (1895). Відповідно до цього методу, в реакцію вводилися етілбромацетат і діетілоксалоацетат в присутності цинку [13] .
З більш пізніх підходів можна відзначити запропоноване в 1973 році перетворення щавелевоуксусной кислоти , Яка при самоконденсаціі з декарбоксилюванням давала цітроілмуравьіную кислоту. Останню потім в присутності пероксиду водню або тре -бутілгідропероксіда перетворювали в лимонну кислоту [14] [15] .
У 1980 році лимонну кислоту отримали по реакції конденсації 3-метилбутен-3-ол-1 і формальдегіду з подальшим окисленням отриманого продукту діоксидом азоту [16] [15] .
Лимонна кислота міститься в різних фруктах, у великій кількості - в цитрусових (приблизно до 5% в плодах і до 9% в соку). У 100 г лайма міститься 7 г лимонної кислоти; лимона - 5,6 г; малини - 2,5 г; чорної смородини - 1,2 г; помідорів - 1,0 г; ананаса і полуниці - 0,6 г; журавлини - 0,2 г; яблука - 14 мг [3] .
Лимонна кислота бере участь в циклі трикарбонових кислот - основному процесі дихання клітини , Тому в деякій помітною концентрації вона міститься в організмі всіх тварин і рослинах [3] .
Сама кислота, як і її солі ( цитрат натрію , цитрат калію , цитрат кальцію , діцітрат Трікалі вісмуту ), Широко використовується як смакова добавка , регулятор кислотності і консервант в харчовій промисловості ( харчові добавки E330-Е333 ), у виробництві плавлених сирів , Напоїв, сухих сумішей для приготування шипучих напоїв.
Застосовується в медицині, в тому числі в складі коштів, що поліпшують енергетичний обмін в циклі Кребса . При прийомі всередину в невеликих дозах, наприклад, при вживанні плодів цитрусових активує цикл Кребса в організмі, що сприяє прискоренню метаболізму .
В косметиці використовується як регулятор кислотності косметичних засобів, як буферних розчинів , хелатуючий агент , В сумішах для приготування «шипучих» ванн.
У нафтової видобутку при бурінні нафтових і газових свердловин використовується для зниження pH бурового розчину після лужних ванн.
У будівництві лимонну кислоту застосовують як добавки до цементному і гіпсовому розчинів для уповільнення зчеплення [17] [18] .
Лимонна кислота може використовуватися для травлення шару міді на друкованих платах [19] в суміші з перекисом водню .
Широко використовується у побутовій хімії в якості очисного кошти нагрівальних поверхонь, наприклад, від накипу на дні чайника.
В кінці 1970-х років в Західній Європі набула поширення містифікація , Відома як « вільжюіфскій список », В якому лимонна кислота була названа сильним канцерогеном [20] . Насправді ж, при харчовому застосуванні лимонна кислота вважається безпечною добавкою.
Згідно з європейським законодавством, лимонну кислоту можна використовувати в GMP без обмежень. американська FDA визначає лимонну кислоту як GRAS ( англ. generally recognized as safe і визнається безпечної) [21] .
Суха лимонна кислота і її концентровані розчини при попаданні в очі викликають сильне роздратування, при контакті зі шкірою можливе слабке роздратування. Одноразово при вживанні всередину великих кількостей лимонної кислоти можливі подразнення слизової оболонки шлунка, кашель, біль, кривава блювота. При вдиханні пилу сухої лимонної кислоти - подразнення дихальних шляхів [22] .
LD50 для щурів перорально: 3 г / кг.
- ↑ Weast RC CRC Handbook of Chemistry and Physics (1st student edition) / RC Weast - 1 - CRC Press , 1988. - ISBN 978-0-8493-0740-9
- ↑ Apelblat, 2014 , P. 1.
- ↑ 1 2 3 Ullmann, 2014 , P. 1.
- ↑ 1 2 Ullmann, 2014 , P. 2.
- ↑ 1 2 Ullmann, 2014 , P. 3.
- ↑ 1 2 3 4 5 Ullmann, 2014 , P. 4.
- ↑ 1 2 Apelblat, 2014 , P. 2.
- ↑ 1 2 3 4 Ullmann, 2014 , P. 4-6.
- ↑ Ullmann, 2014 , P. 6-7.
- ↑ Apelblat, 2014 , P. 213.
- ↑ Apelblat, 2014 , P. 214-215.
- ↑ Apelblat, 2014 , P. 216.
- ↑ Apelblat, 2014 , P. 215.
- ↑ Wiley RH, Kim KS Bimolecular decarboxylative self-condensation of oxaloacetic acid to citrolyformic acid and its conversion by oxidative decarboxylation to citric acid : [ англ. ] // J. Org. Chem .. - 1973. - Vol. 38, no. 20. - P. 3582-3585. - DOI : 10.1021 / jo00960a030 .
- ↑ 1 2 Apelblat, 2014 , P. 216-217.
- ↑ Wilkes JB, Wall RG Reaction of dinitrogen tetraoxide with hydrophilic olefins : synthesis of citric and 2-hydroxy-2-methylbutanedioic acids: [ англ. ] // J. Org. Chem .. - 1980. - Vol. 45, no. 2. - P. 247-250. - DOI : 10.1021 / jo01290a008 .
- ↑ Singh, NB; AK Singh, S. Prabha Singh. Effect of citric acid on the hydration of portland cement (англ.) // Cement and Concrete Research: journal. - 1986. - Vol. 16, no. 6. - P. 911-920. - ISSN 00088846 . - DOI : 10.1016 / 0008-8846 (86) 90015-3 .
- ↑ Козлова В. К., Карпова Ю. В., Вольф А. В. Оцінка ефективності добавок, що уповільнюють схоплювання цементного тесту // ползуновского вісник. - 2006. - Вип. №2-2. - С. 230-233.
- ↑ РадіоКот :: Безпечний загальнодоступний склад для травлення міді в домашніх умовах
- ↑ https://www.jstor.org/pss/2749354
- ↑ Ullmann, 2014 , P. 8.
- ↑ Merck Safety Data Sheet - Citric acid (pdf)













