- сульфіди [ правити | правити код ]
- З'єднання, генетично пов'язані з сірководнем [ правити | правити код ]
- В нормі [ правити | правити код ]
- При патологічних станах [ правити | правити код ]
- Використання для глибокого сну і анабіозу [ правити | правити код ]
сірководень 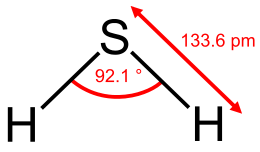
 систематичне
систематичне
найменування сульфід водню Традиційні назви сірководень, сірчистий водень Хім. формула H2S стан газ молярна маса 34.082 г / моль щільність 1.5206 (н.у.) г / літр енергія іонізації 10,46 ± 0,01 еВ [1] Т. плав. -82.30 ° C Т. кип. -60.28 ° C Пр. взрв. 4 ± 1 об.% [1] Тиск пара 17,6 ± 0,1 атм [1] pKa 6.89, 19 ± 2 розчинність в воді 0.025 (40 ° C) Реєстр. номер CAS 7783-06-4 PubChem 402 Реєстр. номер EINECS 231-977-3 SMILES InChI RTECS MX1225000 ChEBI 16136 номер ООН 1 053 ChemSpider 391 ЛД50
713 ppm (щур, 1 година)
673 ppm (миша, 1 година)
634 ppm (миша, 1 година)
444 ppm (щур, 4 години)
600 ppm (людина, 30 хв.)
800 ppm (людина, 5 хв.) токсичність
Високотоксичний, СДОР 

 NFPA 704
NFPA 704
Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Сірководень (сірчистий водень, сульфід водню, дігідросульфід) - безбарвний газ з солодкуватим смаком, що забезпечує характерний неприємний важкий запах тухлих яєць (тухлого м'яса). Бінарне хімічна сполука водню і сірки . Хімічна формула - H2S. Погано розчинний у воді, добре - в етанолі . У великих концентраціях отруйний. Горюча. концентраційні межі займання в суміші з повітрям складають 4,5-45% сірководню. Використовується у хімічної промисловості для синтезу деяких з'єднань, отримання елементарної сірки , сірчаної кислоти , сульфідів . Сірководень також використовують в лікувальних цілях, наприклад в сірководневих ваннах [2] .
У природі зустрічається рідко в складі попутних нафтових газів , природного газу , вулканічних газах , В розчиненому вигляді в природних водах (наприклад, в чорному морі шари води, розташовані глибше 150-200 м, містять розчинений сірководень). Утворюється при гнитті білків , Які містять в складі сірковмісні амінокислоти метіонін і / або цистеїн . Невелика кількість сірководню міститься в кишкових газах людини і тварин.
Термічно стійкий (при температурах більше 400 ° C розкладається на прості речовини - S і H2 ). молекула сірководню має вигнуту форму, тому вона полярна (μ = 0,34⋅10-29 Кл · м). На відміну від води, в сірководні не утворюються водневі зв'язку , Тому сірководень в звичайних умовах не зріджується. розчин сірководню у воді - дуже слабка сірководнева кислота. є сверхпроводником при температурі 203 К (-70 ° C) і тиску 150 ГПа [3] .
власна іонізація рідкого сірководню мізерно мала.
У воді сірководень мало розчинний, водний розчин H2S є дуже слабкою кислотою:
H 2 S → H S - + H + {\ displaystyle {\ mathsf {H_ {2} S \ rightarrow HS ^ {-} + H ^ {+}}}} K a = 6,9⋅10-7; p K a = 6,89.
реагує з лугами :
H 2 S + 2 N a O H → N a 2 S + 2 H 2 O {\ displaystyle {\ mathsf {H_ {2} S + 2NaOH \ rightarrow Na_ {2} S + 2H_ {2} O}}} (Середня сіль, при надлишку NaOH) H 2 S + N a O H → N a H S + H 2 O {\ displaystyle {\ mathsf {H_ {2} S + NaOH \ rightarrow NaHS + H_ {2} O}}}
(Кисла сіль, при відношенні 1: 1)
Сірководень - сильний відновник . Окислювально-відновні потенціали:
S + 2 e - → S 2 - (E h = - 0.444 B) {\ displaystyle {\ mathsf {S + 2e ^ {-} \ rightarrow S ^ {2 -} (Eh = -0.444B)}}} S + 2 H + + 2 e - → H 2 S (E h = 0.144 B) {\ displaystyle {\ mathsf {S + 2H ^ {+} + 2 e ^ {-} \ rightarrow H_ {2} S (Eh = 0.144B)}}}
В повітрі горить синім полум'ям:
2 H 2 S + 3 O 2 → 2 H 2 O + 2 S O 2 {\ displaystyle {\ mathsf {2H_ {2} S + 3O_ {2} \ rightarrow 2H_ {2} O + 2SO_ {2}}}}
при нестачі кисню :
2 H 2 S + O 2 → 2 S + 2 H 2 O {\ displaystyle {\ mathsf {2H_ {2} S + O_ {2} \ rightarrow 2S + 2H_ {2} O}}} (На цій реакції заснований промисловий спосіб отримання сірки ).
Сірководень реагує також з багатьма іншими окислювачами, при його окисленні в розчинах утворюється вільна сірка або іон SO42-, наприклад:
3 H 2 S + 4 HC l O 3 → 3 H 2 SO 4 + 4 HC l {\ displaystyle {\ mathsf {3H_ {2} S + 4HClO_ {3} \ rightarrow 3H_ {2} SO_ {4} + 4HCl} }} 2 H 2 S + S O 2 → 2 H 2 O + 3 S {\ displaystyle {\ mathsf {2H_ {2} S + SO_ {2} \ rightarrow 2H_ {2} O + 3S}}}
якісною реакцією на сірководневу кислоту і її солі є їх взаємодія з солями свинцю , При якому утворюється чорний осад сульфіду свинцю , наприклад [4] :
H 2 S + P b (NO 3) 2 → P b S ↓ + 2 HNO 3 {\ displaystyle {\ mathsf {H_ {2} S + Pb (NO_ {3}) _ {2} \ rightarrow PbS {\ downarrow } + 2HNO_ {3}}}}
При пропущенні сірководню через людську кров вона чорніє, оскільки гемоглобін руйнується і залізо , Що входить до його складу і додає крові червоний колір, вступає в реакцію з сірководнем і утворює чорний сульфід заліза [4] .
сульфіди [ правити | правити код ]
Солі сірководневої кислоти називають сульфідами . У воді добре розчинні тільки сульфіди лужних металів , амонію . Сульфіди інших металів практично не розчинні у воді, вони випадають в осад при введенні в розчини солей металів і розчинної солі сірководневої кислоти, наприклад сульфіду амонію (NH4) 2S. Багато сульфіди яскраво пофарбовані.
Для всіх лужних і лужноземельних металів відомі також гідросульфіди M + HS і M2 + (HS) ². Гідросульфіди Са2 + і Sr2 + дуже нестійкі. Будучи солями слабкої кислоти , У водному розчині розчинні сульфіди піддаються гідролізу . Гідроліз сульфідів, що містять метали в високих ступенях окислення, або гідроксиди яких є дуже слабкими підставами (наприклад, Al2S3, Cr2S3 і ін.), Часто проходить необоротно з випаданням в осад нерозчинного гідроксиду.
Сульфіди застосовуються в техніці, наприклад напівпровідники і люмінофори ( сульфід кадмію , сульфід цинку ), мастильні матеріали ( дисульфід молібдену ) та ін.
Багато природних сульфіди у вигляді мінералів є цінними рудами ( пірит , халькопирит , кіновар , молибденит ).
Приклад окислення сульфіду перекисом водню :
P b S + 4 H 2 O 2 = P b S O 4 + 4 H 2 O {\ displaystyle {\ mathsf {PbS + 4H_ {2} O_ {2} = PbSO_ {4} + 4H_ {2} O}}}
- взаємодією розбавлених кислот з сульфідами:
F e S + 2 H C l ⟶ F e C l 2 + H 2 S ↑ {\ displaystyle {\ mathsf {FeS + 2 \ HCl \ longrightarrow \ FeCl_ {2} + \ H_ {2} S \ uparrow}}}
A l 2 S 3 + 6 H 2 O ⟶ 2 A l (OH) 3 ↓ + 3 H 2 S ↑ {\ displaystyle {\ mathsf {Al_ {2} S_ {3} +6 \ H_ {2} O \ longrightarrow 2 \ Al (OH) _ {3} \ downarrow +3 \ H_ {2} S \ uparrow}}}
- Сплавлением парафіну з сіркою.
З'єднання, генетично пов'язані з сірководнем [ правити | правити код ]
Є першим членом в ряді полісероводородов ( сульфаніл ) - H2Sn (виділені полісероводороди з n = 1 ÷ 8) [5] .
Сірководень через свою токсичність знаходить обмежене застосування.
В нормі [ правити | правити код ]
Ендогенний сірководень проводиться в невеликих кількостях клітинами ссавців і виконує ряд важливих біологічних функцій, в тому числі сигнальну. Це третій з відкритих « газотрансміттеров »(Після окису азоту і чадного газу ).
Ендогенний сірководень утворюється в організмі з цистеїну за допомогою ферментів цистатіонін-β-синтетази і цистатіонін-γ-ліази. Він є спазмолитиком (розслабляє гладкі м'язи ) і вазодилятатором , Подібно до окису азоту і чадного газу [6] . Він також проявляє активність в ЦНС , Де він підвищує NMDA-опосередковану нейротрансмісію і сприяє довготривалого запам'ятовування інформації [7] .
Надалі сірководень окислюється до сульфит-іона в мітохондріях за допомогою ферменту тіосульфат-редуктази. Сульфит-іон в подальшому окислюється до тіосульфат-іона і потім в сульфат-іон ферментом сульфит-оксидазой. Сульфати, як кінцевий продукт метаболізму, виводяться із сечею [8] .
Завдяки властивостям, подібним з властивостями окису азоту (але без її здатності утворювати пероксиди , Реагуючи з супероксидом ), Ендогенний сірководень вважається зараз одним з важливих факторів, що захищають організм від серцево-судинних захворювань [6] . Відомі Кардіопротектівние властивості часнику звязані з катаболизмом полісульфідних груп аллицина в сірководень, причому ця реакція каталізується відновні властивості глютатиона [9] .
Хоча і оксид азоту (I) N2O, і сірководень здатні розслабляти м'язи і викликати вазодилатацию , Їх механізми дії, судячи з усього, різні. У той час як оксид азоту активує фермент гуанілатциклазу, сірководень активує АТФ-чутливі калієві канали в клітинах гладеньких м'язів. Дослідникам до теперішнього часу неясно, як розподіляються фізіологічні ролі в регулюванні тонусу судин між окисом азоту, чадним газом і сірководнем. Однак існують деякі дані, що дозволяють припустити, що окис азоту в фізіологічних умовах в основному розширює великі судини, в той час як сірководень відповідальний за аналогічне розширення дрібних кровоносних судин [10] .
Останні дослідження змушують припускати значне внутрішньоклітинний крос-спілкування між сигнальними шляхами оксиду азоту (I) і сигнальними шляхами сірководню [11] , Що демонструють, що вазодилатуючі, спазмолітичні, протизапальні і цитопротективний властивості цих газів взаємозалежні і взаімодополняющі. Крім того, показано, що сірководень здатний реагувати з внутрішньоклітинними S-нітрозотіолів, в результаті чого утворюється найменший можливий S-нітрозотіолів - HSNO. Це змушує припускати, що сірководень грає роль в контролі за рівнем внутрішньоклітинного вмісту S-нітрозотіолів [12] .
Подібно окису азоту, сірководень грає роль в розширенні судин статевого члена , Необхідному для здійснення ерекції , Що створює нові можливості для терапії еректильної дисфункції за допомогою тих чи інших засобів, що підвищують продукцію ендогенного сірководню [13] [14] .
При патологічних станах [ правити | правити код ]
при інфаркті міокарда виявляється виражений дефіцит ендогенного сірководню, що може мати несприятливі наслідки для судин. [15] Інфаркт міокарда призводить до некрозу серцевого м'яза в зоні інфаркту через два різних механізму: один - це підвищений оксидативний стрес і підвищене утворення вільних радикалів, і інший - це знижена біодоступність ендогенних вазодилататорів і «захисників» тканин від вільнорадикального ушкодження - окису азоту і сірководню. [16] Підвищене утворення вільних радикалів відбувається внаслідок підвищеного незв'язаного електронного транспорту в активному сайті ферменту ендотеліальної синтази оксиду азоту - ферменту, відповідального за перетворення L-аргініну в окис азоту. [15] [16] Під час інфаркту, окислювальна деградація тетрагідробіоптеріна, кофактора в процесі виробництва окису азоту, обмежує доступність тетрагідробіоптеріна і відповідно обмежує здатність синтази оксиду азоту до виробництва NO. [16] В результаті синтаза оксиду азоту реагує з киснем, іншим косубстрата, необхідним для виробництва окису азоту. Результатом цього є утворення супероксидів, підвищене утворення вільних радикалів і внутрішньоклітинний оксидативний стрес. [15] Дефіцит сірководню ще більше погіршує цю ситуацію, порушуючи активність синтази оксиду азоту за рахунок обмеження активності Akt і гноблення фосфорилювання Akt синтази оксиду азоту в сайті eNOSS1177, необхідному для її активації. [15] [17] Замість цього при дефіциті сірководню активність Akt змінюється таким чином, що Akt фосфорилирует інгібуючий сайт синтази оксиду азоту - eNOST495 - що призводить до ще більшого пригнічення біосинтезу оксиду азоту. [15] [17]
«Сірководнева терапія» використовує донор або прекурсор сірководню, такий як Діалло-трисульфід, для того, щоб підвищити вміст сірководню в крові і тканинах пацієнта з інфарктом міокарда. Донори або прекурсори сірководню зменшують пошкодження міокарда після ішемії і реперфузії і ризик ускладнень інфаркту міокарда. [15] Підвищені рівні сірководню в тканинах і крові реагують з киснем, що містяться в крові і тканинах, в результаті чого утворюється сульфани-сірка, проміжний продукт, у складі якого сірководень «запасається», зберігається і транспортується в клітини. [15] Пули сірководню в тканинах реагують з киснем, підвищення вмісту сірководню в тканинах активує синтазу оксиду азоту і тим самим підвищує продукцію окису азоту. [15] Внаслідок підвищення використання кисню для виробництва окису азоту, менше кисню залишається для реагування з ендотеліальної синтази оксиду азоту та виробництва супероксидів, підвищеного при інфаркті, що в підсумку призводить до зменшення утворення вільних радикалів. [15] Крім того, менше утворення вільних радикалів знижує оксидативний стрес в клітинах гладеньких м'язів судин, знижуючи тим самим окислительную деградацію тетрагідробіоптеріна. [16] Підвищення доступності кофактора синтази оксиду азоту - тетрагідробіоптеріна - також сприяє збільшенню продукції окису азоту в організмі. [16] Крім того, більш високі концентрації сірководню безпосередньо підвищують активність синтази оксиду азоту через активацію Akt, що призводить до підвищення фосфорилювання активує сайту eNOSS1177 і зниження фосфорилювання ингибирующего сайту eNOST495. [15] [17] Це фосфорилювання призводить до підвищення каталітичної активності синтази оксиду азоту, що призводить до більш ефективного і більш швидкого перетворення L-аргініну в окис азоту і підвищення концентрації окису азоту. [15] [17] Підвищення концентрації окису азоту підвищує активність розчинної гуанілатциклази, що, в свою чергу, призводить до підвищення освіти циклічного гуанозинмонофосфату цГМФ з ГТФ . [18] Підвищення рівня циклічного ГМФ призводить до підвищення активності протеїнкінази G (PKG). [19] А протеинкиназа G призводить до зниження рівня внутрішньоклітинного кальцію в гладких м'язах стінок судин, що призводить до їх розслабленню і посилення кровотоку в судинах. [19] Крім того, протеинкиназа G також обмежує проліферацію клітин гладких м'язів стінок судин, зменшуючи тим самим потовщення інтими судин. В кінцевому підсумку «сірководнева терапія» призводить до зменшення розмірів зони інфаркту. [15] [18]
при хвороби Альцгеймера рівень сірководню в мозку різко знижений. [20] У моделі на щурах хвороби Паркінсона концентрація сірководню в мозку щурів також виявилася зниженою, причому введення щурам донорів або прекурсорів сірководню покращувало стан тварин аж до повного зникнення симптомів. [21] при трисомії 21 (Синдром Дауна) організм, навпаки, виробляє надлишкову кількість сірководню. [8] Ендогенний сірководень також залучений в патогенез цукрового діабету 1-го типу. Бета-клітини підшлункової залози хворих на цукровий діабет 1-го типу виробляють надмірно підвищені кількості сірководню, що призводить до загибелі цих клітин і до зниження секреції інсуліну сусідніми, поки ще живими, клітинами. [10]
Використання для глибокого сну і анабіозу [ правити | правити код ]
У 2005 році було показано, що миша можна занурити в стан майже анабіозу : штучної гіпотермії , Піддавши її впливу низьких концентрацій сірководню (81 ppm) у вдихуваному повітрі. Дихання тварин сповільнилося зі 120 до 10 дихальних рухів в хвилину, а їх температура тіла впала з 37 градусів Цельсія до рівня, всього на 2 градуси Цельсія перевищує температуру навколишнього середовища (тобто ефект був такий, як ніби теплокровних тварин раптово стало холоднокровним). Миші пережили цю процедуру протягом 6 годин, причому після цього у них не спостерігалося жодних негативних наслідків для здоров'я, порушень поведінки або будь-яких пошкоджень внутрішніх органів [22] У 2006 році було показано, що артеріальний тиск у миші, підданої подібним чином впливу сірководню, істотно не знижується [23] .
Подібний процес, відомий як гібернація або «зимова сплячка», спостерігається в природі у багатьох видів ссавців , А також у жаб , Але не у миші (хоча миша може впадати в ступор при довгій відсутності їжі). Було показано, що під час «зимової сплячки» продукція ендогенного сірководню у тих тварин, які впадають в зимову сплячку, значно підвищується. Теоретично, якщо б вдалося змусити спричинюється сірководнем гібернацію настільки ж ефективно працювати у людей, це могло б бути дуже корисним в клінічній практиці для порятунку життя важко травмованих або перенесли важку гіпоксію, інфаркти, інсульти хворих, а також для консервації донорських органів. У 2008 році було показано, що гіпотермія, викликана сірководнем протягом 48 годин, у щурів здатна зменшувати ступінь пошкодження головного мозку, що викликається експериментальним інсультом або травмою мозку [24] .
Сірководень зв'язується з цитохромоксидазой C і тим самим запобігає зв'язування з нею кисню, що призводить до різкого уповільнення метаболізму, але в великих кількостях «паралізує» клітинне дихання і призводить до «задухи» на рівні клітини - до клітинної гіпоксії. І у людини, і у тварин все клітини організму в нормі виробляють деяку кількість сірководню. Ряд дослідників припустили, що, крім інших фізіологічних ролей, сірководень також використовується організмом для природної саморегуляції швидкості метаболізму (метаболічної активності), температури тіла і споживання кисню, що може пояснити вищеописане наступ глибокого сну у мишей і щурів при підвищених концентраціях сірководню, а також підвищення його концентрації при фізіологічній сплячці у тварин [25] .
Однак два останніх дослідження викликають сумніви в тому, що цього ефекту глибокого сну і індукції гіпометаболізм за допомогою сірководню можливо досягти у більших тварин. Так, дослідження 2008 року не змогло відтворити цей же ефект на свинях, що привело дослідників до висновку, що ефект, який спостерігається у мишей, не спостерігається у більших тварин [26] . Аналогічно інша стаття зазначає, що ефекту індукції гіпометаболізм і глибокого сну за допомогою сірководню, легко досяжного у мишей і щурів, не вдається досягти у овець [27] .
У лютому 2010 року вчений Марк Рот заявив на конференції, що викликана сірководнем гіпотермія у людини пройшла I фазу клінічних випробувань [28] . Однак рішення про проведення подальших клінічних випробувань на хворих з інфарктом було відкликано заснованої ним компанією Ikaria в серпні 2011 року ще до початку набору учасників випробувань без пояснення причин з посиланням на «рішення компанії» [29] [30] .
Дуже токсичний. Вдихання повітря з невеликим вмістом сірководню викликає запаморочення , головний біль , нудоту , А зі значною концентрацією призводить до комі , судом , набряку легенів і навіть до летального результату. При високій концентрації одноразове вдихання може викликати миттєву смерть . При вдиханні повітря з невеликими концентраціями у людини досить швидко виникає адаптація до неприємного запаху «Тухлих яєць» і він перестає відчуватися. У роті виникає солодкуватий металевий присмак [31] .
При вдиханні повітря з великою концентрацією через параліч нюхового нерва запах сірководню майже відразу перестає відчуватися.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0337.html
- ↑ Польза сероводородных ванн
- ↑ А. П. Дроздов, М. І. Еремець, І. А. Троян, В. Ксенофонтов, С. І. Шилін. Звичайна надпровідність при 203 кельвінах при високих тисках в системі гідриду сірки // Природа. - Т. 525, вып. 7567. - с. 73–76. - DOI : 10.1038 / nature14964 .
- ↑ 1 2 Ходаков Ю.В., Епштейн Д.А., глоріоза П.А. § 88. Сероводород // Неорганическая химия: Учебник для 7—8 классов средней школы. - 18-е изд. - М .: Просвітництво , 1987. - С. 206—207. - 240 с. - 1 630 000 экз.
- ↑ Хімічна енциклопедія / Редкол.: Кнунянц І.Л. и др .. - М. : Советская энциклопедия, 1995. - Т. 4 (Пол-Три). - 639 с. - ISBN 5-82270-092-4 .
- ↑ 1 2 Lefer, David J. (листопад 2007). "Виникає нова газоподібна сигнальна молекула: кардіопротекторна роль сірководню" . PNAS . 104 (46): 17907—17908. Bibcode : 2007PNAS..10417907L . DOI : 10.1073 / pnas.0709010104 . PMC 2084269 . PMID 17991773 .
- ↑ Кімура, Хідео (2002). «Сірководень як нейромодулятор». Молекулярна нейробіологія . 26 (1): 13—19. DOI : 10.1385 / МН: 26: 1: 013 . PMID 12392053 .
- ↑ 1 2 Камун, П'єр (липень 2004 року). “H2S, новий нейромодулятор”. Медицина / Науки . 20 (6—7): 697—700. DOI : 10.1051 / medsci / 2004206-7697 . PMID 15329822 .
- ↑ Benavides, Gloria A; Squadrito, Giuseppe L; Міллс, Роберт W; Patel, Hetal D; Isbell, T Скотт; Patel, Rakesh P; Дарлі-Усмар, Віктор М ; Доеллер, Жаннет Е; Краус, Девід W (2007-11-13). "Сірководень опосередковує вазоактивність часнику" . Праці Національної академії наук Сполучених Штатів Америки . 104 (46): 17977—17982. Bibcode : 2007PNAS..10417977B . DOI : 10.1073 / pnas.0705710104 . PMC 2084282 . PMID 17951430 .
- ↑ 1 2 « Токсичний газ, рятувальник », Scientific American , березень 2010
- ↑ Coletta C., Papapetropoulos A., Erdelyi K., Olah G., Módis K., Panopoulos P., Asimakopoulou A., Gerö D., Sharina I., Martin E., Szabo C. Сірководень і оксид азоту взаємно залежні в регуляції ангіогенезу і ендотелій-залежної вазорелаксації. (англ.) // Праці Національної академії наук Сполучених Штатів Америки. - 2012. - Вип. 109, №. 23. - P. 9161—9166. - DOI : 10.1073 / pna.1202916109 . - PMID 22570497 . [ исправить ]
- ↑ Філіпович М.Р., Мількович Я. Л., Наусер Т., Ройзен М., Клос К., Шубіна Т., Коппенол В. Г., Ліппард С. Я., Іванович-Бурмазович І. Хімічна характеристика найменшого S-нітрозотіола, HSNO; клітинні перехресні зв'язки H2S і S-нітрозотіолів. (англ.) // Журнал Американського хімічного товариства. - 2012. - Вип. 134, ні. 29. - P. 12016—12027. - DOI : 10.1021 / ja3009693 . - PMID 22741609 . [ исправить ]
- ↑ Роберта д'Емануеле ді Вілла Б'янка, Рафаелла Соррентіноа, Паскуале Маффіа, Вінченцо Міронеб, Сіро Імбімбоб, Фердінандо Фускоб, Раффаеле де Пальмад, Луї Дж. "Сірководень як медіатор кавернозного тіла людини з гладкою м'язовою релаксацією" . PNAS . 106 (11): 4513—8. Bibcode : 2009PNAS..106.4513D . DOI : 10.1073 / pnas.0807974105 . PMC 2657379 . PMID 19255435 .
- ↑ Сульфід водню: потенційна допомога для ED (неопр.). WebMD (2 березня 2009 року).
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 Король, Адрієнн; Polhemus, Bhushan, Otsuka, Кондо, Ніколсон, Бредлі, Іслам, Калверт, Дао, Дугас, Келі, Елрод, Хуан, Ван, Лефер; Bhushan, S .; Otsuka, H .; Kondo, K .; Nicholson, CK; Bradley, JM; Islam, KN; Calvert, JW; Tao, Y.-X .; Dugas, TR; Kelley, EE; Elrod, JW; Huang, PL; Wang, R .; Lefer, DJ (січень 2014). "Цитопротекторна сигналізація з сірководнем є залежною від ендотеліальної оксиду азоту синтазо-азотної оксидом". PNAS . 111 (Рання редакція): 1-6. Bibcode : 2014PNAS..111.3182K . DOI : 10.1073 / pna.1321871111 .
- ↑ 1 2 3 4 5 Альп, Микола; Channon (2003). «Регулювання ендотеліальної синтази оксиду азоту тетрагідробіоптеріном при судинних захворюваннях». Журнал Американської асоціації серця . 24 : 413—420. DOI : 10.1161 / 01.ATV0000110785.96039.f6 .
- ↑ 1 2 3 4 Coletta, Ciro; Папапетропулос, Ерделі, Олах, Модіс, Панопулос, Асімакопулу, Геро, Шарина, Мартін, Сабо; Ерделі, К .; Olah, G .; Modis, K .; Panopoulos, P .; Asimakopoulou, A .; Gero, D .; Sharina, I .; Martin, E .; Szabo, C. (квітень 2012). "Сірководень і оксид азоту взаємно залежні в регуляції ангіогенезу та ендотелій-залежної вазорелаксації" . PNAS . 109 (23): 9161—9166. Bibcode : 2012PNAS..109.9161C . DOI : 10.1073 / pna.1202916109 . PMC 3384190 . PMID 22570497 .
- ↑ 1 2 Boerth, NJ; Dey, Cornwell, Lincoln (1997). "Циклічна GMP-залежна протеїнкіназа регулює фенотип клітин гладких м'язів судин". Журнал судинних досліджень . 34 (4): 245—259. DOI : 10.1159 / 000159231 . PMID 9256084 .
- ↑ 1 2 Lincoln, TM; Корнуелл, Тейлор (березень 1990). "ЦГМФ-залежна протеїнкіназа опосередковує зниження Са2 + цАМФ у гладком'язових клітинах судин" . Американський журнал фізіології . 258 (3): C399 — C407. PMID 2156436 .
- ↑ Eto, Ko; Такаші Асада; Kunimasa Arima; Takao Makifuchi; Хідео Кімура (2002-05-24). "Сірководень мозку сильно знижений при хворобі Альцгеймера" . Зв'язок біохімічних та біофізичних досліджень . 293 (5): 1485—1488. DOI : 10.1016 / S0006-291X (02) 00422-9 . PMID 12054683 .
- ↑ Hu LF, Lu M., Tiong CX, Dawe GS, Hu G., Bian JS Нейропротекторні ефекти сірководню на моделі хвороби Паркінсона. (англ.) // Старіння клітини. - 2010. - Вип. 9, №. 2. - С. 135—146. - DOI : 10.1111 / j.1474-9726.2009.00543.x . - PMID 20041858 . [ исправить ]
- ↑ Миші розміщені в "призупиненій анімації" , BBC News, 21 квітня 2005 року
- ↑ Газ викликає «призупинення» , BBC News, 9 жовтня 2006 року
- ↑ Florian B, Vintilescu R, Balseanu AT, Buga AM, Grisk O, Walker LC, Kessler C, Popa-Wagner A; Vintilescu; Balseanu; Buga; Grisk; Walker; Кесслер; Попа-Вагнер (2008). «Довготривала гіпотермія зменшує об'єм інфаркту у старих щурів після фокальної ішемії». Літери неврології . 438 (2): 180—185. DOI : 10.1016 / j.neulet.2008.04.020 . PMID 18456407 .
- ↑ Марк Б. Рот і Тодд Ністул. Час купівлі в призупиненій анімації. Scientific American, 1 червня 2005 року
- ↑ Лі, Цзя; Чжан, Генчен; Cai, Sally; Редінгтон, Ендрю Н (січень 2008). "Вплив вдихуваного сірководню на метаболічні реакції в анестезованих, паралізованих і механічно вентильованих поросятах" . Дитяча медицина критичного догляду . 9 (1): 110-112. DOI : 10.1097 / 01.PCC.0000298639.08519.0C . PMID 18477923 . H2S, здається, не має гіпометаболічних ефектів у великих ссавців, охоплених навколишнім середовищем, і, навпаки, діє як гемодинамічний і метаболічний стимулятор.
- ↑ Haouzi P, Notet V, Chenuel B, Шалон B, Sponne I, Ogier V; та ін. (2008). «Гідрометаболізм, індукований H2S у мишей, відсутній у седованих овець». Respir Physiol Neurobiol . 160 (1): 109—15. DOI : 10.1016 / j.resp.2007.09.001 . PMID 17980679 .
- ↑ Марк Рот: Призупинена анімація знаходиться в межах нашої досяжності (неопр.).
- ↑ IK-1001 (Сульфід натрію (Na2S) для ін'єкцій) у пацієнтів з гострим інфарктом міокарда висоти сегмента ST (неопр.). ClinicalTrials.gov (4 листопада 2010). - «Це дослідження було скасовано до початку навчання. (Рішення компанії. Не пов'язане з безпекою) ».
- ↑ Зниження ішемії-реперфузійної кардіологічної травми у суб'єктів, які перенесли коронарну артерію \ t (неопр.). ClinicalTrials.gov (3 серпня 2011). - «Це дослідження було припинено. (Дослідження припинено - рішення компанії) ».
- ↑ Довготривалий вплив на нюхову систему впливу сірководню / AR Hirsch та G Zavala Лікування запаху і смаку та дослідження досліджень, Чикаго, IL 60611, США.
- Карапетьянц М. Х. , Дракин С. І. Загальна та неорганічна хімія. - М.: Хімія, 1994.
- Ахметов Н. С. Загальна та неорганічна хімія. - М .: Вища школа, 2001 ..
- Малин К. М. Справочник сернокислотчика. - М .: Химия, 1971.













