АЛЮМІНІЙ, хімічний елемент III групи періодичної системи, атомний номер 13, відносна атомна маса 26,98. У природі представлений лише одним стабільним нуклідом 27Al. Штучно отримано ряд радіоактивних ізотопів алюмінію, найбільш долгоживущий - 26Al має період напіврозпаду 720 тисяч років.
Алюміній в природі.
У земній корі алюмінію дуже багато: 8,6% за масою. Він посідає перше місце серед усіх металів і третє серед інших елементів (після кисню і кремнію). Алюмінію вдвічі більше, ніж заліза, і в 350 разів більше, ніж міді, цинку, хрому, олова і свинцю разом узятих! Як писав понад 100 років тому в своєму класичному підручнику Основи хімії Д. І. Менделєєв , З усіх металів «алюміній є найпоширеніший в природі; досить вказати на те, що він входить до складу глини, щоб ясно було загальне поширення алюмінію в корі земної. Алюміній, або метал квасцов (alumen), тому і називається інакше глинием, що знаходиться в глині ».
Найважливіший мінерал алюмінію - боксит, суміш основного оксиду AlO (OH) і гідроксиду Al (OH) 3. Найбільші родовища бокситу знаходяться в Австралії, Бразилії, Гвінеї і на Ямайці; промисловий видобуток ведеться і в інших країнах. Багаті алюмінієм також алуніт (квасцовий камінь) (Na, K) 2SO4 · Al2 (SO4) 3 · 4Al (OH) 3, нефелин (Na, K) 2O · Al2O3 · 2SiO2. Всього ж відомо більше 250 мінералів, до складу яких входить алюміній; більшість з них - алюмосилікати, з яких і утворена в основному земна кора. При їх вивітрюванні утворюється глина, основу якої становить мінерал каолініт Al2O3 · 2SiO2 · 2H2O. Домішки заліза зазвичай фарбують глину в бурий колір, але зустрічаються і біла глина - каолін, яку застосовують для виготовлення фарфорових і фаянсових виробів. Див. Також бокситів.
Зрідка зустрічається винятково твердий (поступається лише алмазу) мінерал корунд - кристалічний оксид Al2O3, часто пофарбований домішками в різні кольори. Його синя різновид (домішка титана та заліза) називається сапфіром, червона (домішка хрому) - рубіном. Різні домішки можуть фарбувати так званий благородний корунд також в зелений, жовтий, помаранчевий, фіолетовий і інші кольори і відтінки.
Ще недавно вважалося, що алюміній як вельми активний метал не може зустрічатися в природі у вільному стані, однак в 1978 році в породах Сибірської платформи був виявлений самородний алюміній - у вигляді ниткоподібних кристалів довжиною всього 0,5 мм (при товщині ниток кілька мікрометрів). У місячному грунті, доставленому на Землю з районів морів Криз і Достатку, також вдалося виявити самородний алюміній. Припускають, що металевий алюміній може утворитися конденсацією з газу. Відомо, що при нагріванні галогенідів алюмінію - хлориду, броміду, фториду вони можуть з більшою чи меншою легкістю випаровуватися (так, AlCl3 переганяється вже при 180 ° C). При сильному підвищенні температури галогеніди алюмінію розкладаються, переходячи в стан з нижчою валентністю металу, наприклад, AlCl. Коли при зниженні температури і відсутності кисню таке з'єднання конденсується, у твердій фазі відбувається реакція диспропорціонування: частина атомів алюмінію окислюється і переходить в звичне тривалентне стан, а частина - відновлюється. Відновитися ж одновалентних алюміній може тільки до металу: 3AlCl ® 2Al + AlCl3. На користь цього припущення говорить і ниткоподібна форма кристалів самородної алюмінію. Зазвичай кристали такої будови утворюються внаслідок швидкого зростання з газової фази. Ймовірно, мікроскопічні самородки алюмінію в місячному грунті утворилися аналогічним способом.
Назва алюмінію походить від латинського alumen (рід. Падіж aluminis). Так називали галун, подвійний сульфат калію-алюмінію KAl (SO4) 2 · 12H2O), які використовували як протравлення при фарбуванні тканин. Латинська назва, ймовірно, походить від грецького «халме» - розсіл, соляний розчин. Цікаво, що в Англії алюміній - це aluminium, а в США - aluminum.
У багатьох популярних книгах з хімії наводиться легенда про те, що якийсь винахідник, ім'я якого історія не зберегла, приніс імператору Тиберію, що правив Римом в 14-27 н.е., чашу з металу, що нагадує кольором срібло, але більш легкого. Цей подарунок коштував життя майстру: Тиберій наказав стратити його, а майстерню знищити, оскільки боявся, що новий метал може знецінити срібло в імператорській скарбниці.
Ця легенда заснована на розповіді Плінія Старшого , Римського письменника і вченого, автора Природною історії - енциклопедії природничонаукових знань античних часів. Згідно Плинию, новий метал був отриманий з «глинистої землі». А адже глина дійсно містить алюміній.
Сучасні автори майже завжди роблять застереження, що вся ця історія - не більше ніж красива казка. І це не дивно: алюміній в гірських породах надзвичайно міцно пов'язаний з киснем, і для його виділення необхідно затратити дуже багато енергії. Однак останнім часом з'явилися нові дані про принципову можливість отримання металевого алюмінію в давнину. Як показав спектральний аналіз, прикраси на гробниці китайського полководця Чжоу-Чжу, який помер на початку III ст. н.е., зроблені зі сплаву, на 85% складається з алюмінію. Чи могли древні отримати вільний алюміній? Всі відомі способи (електроліз, відновлення металевим натрієм або калієм) відпадають автоматично. Чи могли в давнину знайти самородний алюміній, як, наприклад, самородки золота, срібла, міді? Це теж виключено: самородний алюміній - рідкісний мінерал, який зустрічається в незначних кількостях, так що стародавні майстри ніяк не могли знайти і зібрати в потрібній кількості такі самородки.
Однак можливе й інше пояснення розповіді Плінія. Алюміній можна відновити з руд не тільки за допомогою електрики і лужних металів. Існує доступний і широко використовуваний з давніх часів відновник - це вугілля, за допомогою якого оксиди багатьох металів при нагріванні відновлюються до вільних металів. В кінці 1970-х німецькі хіміки вирішили перевірити, чи могли в давнину отримати алюміній відновленням вугіллям. Вони нагріли в глиняному тиглі до червоного розжарювання суміш глини з вугільним порошком і кухонною сіллю або поташом (карбонатом калію). Сіль була отримана з морської води, а поташ - з золи рослин, щоб використовувати тільки ті речовини і методи, які були доступні в давнину. Через деякий час на поверхні тигля сплив шлак з кульками алюмінію! Вихід металу був малий, але не виключено, що саме цим шляхом стародавні металурги могли отримати «метал 20 століття».
Властивості алюмінію.
За кольором чистий алюміній нагадує срібло, це дуже легкий метал: його щільність всього 2,7 г / см3. Легше алюмінію тільки лужні і лужноземельні метали (крім барію), берилій і магній. Плавиться алюміній теж легко - при 600 ° С (тонку алюмінієвий дріт можна розплавити на звичайній кухонній конфорці), зате кипить лише при 2452 ° С. За електропровідності алюміній - на 4-му місці, поступаючись лише сріблу (воно на першому місці), міді і золота, що при дешевизні алюмінію має величезне практичне значення. У такому ж порядку змінюється і теплопровідність металів. У високій теплопровідності алюмінію легко переконатися, опустивши алюмінієву ложечку в гарячий чай. І ще одна чудова властивість у цього металу: його рівна блискуча поверхня чудово відображає світло: від 80 до 93% у видимій області спектра в залежності від довжини хвилі. В ультрафіолетовій області алюмінію в цьому відношенні взагалі немає рівних, і лише в червоній області він трохи поступається сріблу (в ультрафіолеті срібло має дуже низьку відбивну здатність).
Чистий алюміній - досить м'який метал - майже втричі м'якше міді, тому навіть порівняно товсті алюмінієві пластинки і стрижні легко зігнути, але коли алюміній утворює сплави (їх відомо безліч), його твердість може зрости в десятки разів.
Характерна ступінь окислення алюмінію +3, але завдяки наявності незаповнених 3 р - і 3 d орбіталей атоми алюмінію можуть утворювати додаткові донорно-акцепторні зв'язки. Тому іон Al3 + з невеликим радіусом надто схильний до комплексообразованию, утворюючи різноманітні катіонні і аніонні комплекси: AlCl4-, AlF63-, [Al (H2O) 6] 3+, Al (OH) 4, Al (OH) 63-, AlH4- і багато інших. Відомі комплекси і з органічними сполуками.
Хімічна активність алюмінію дуже висока; в ряду електроднихпотенціалів він стоїть відразу за магнієм. На перший погляд таке твердження може здатися дивним: адже алюмінієва каструля або ложка цілком стійкі на повітрі, не руйнуються і в киплячій воді. Алюміній, на відміну від заліза, не іржавіє. Виявляється, на повітрі метал покривається безбарвною тонкою, але міцною «бронею» з оксиду, яка захищає метал від окислення. Так, якщо внести в полум'я пальника товсту алюмінієвий дріт або пластинку товщиною 0,5-1 мм, то метал плавиться, але алюміній не тече, так як залишається в мішечку з його оксиду. Якщо позбавити алюміній захисної плівки або зробити її пухкої (наприклад, зануренням в розчин ртутних солей), алюміній тут же проявить свою справжню сутність: вже при кімнатній температурі почне енергійно реагувати з водою з виділенням водню: 2Al + 6H2O ® 2Al (OH) 3 + 3H2. На повітрі позбавлений захисної плівки алюміній прямо на очах перетворюється в пухкий порошок оксиду: 2Al + 3O2 ® 2Al2O3. Особливо активний алюміній в мелкораздробленном стані; алюмінієвий пил при вдування в полум'я вмить згорає. Якщо змішати на керамічній пластинці алюмінієву пил з пероксидом натрію і капнути на суміш водою, алюміній також спалахує і згорає білим полум'ям.
Дуже високу спорідненість алюмінію до кисню дозволяє йому «віднімати» кисень від оксидів ряду інших металів, відновлюючи їх (метод алюминотермии). Найвідоміший приклад - термітна суміш, при горінні якої виділяється так багато тепла, що отримане залізо розплавляється: 8Al + 3Fe3O4 ® 4Al2O3 + 9Fe. Ця реакція була відкрита в 1856 Н.Н.Бекетова. Таким способом можна відновити до металів Fe2O3, CoO, NiO, MoO3, V2O5, SnO2, CuO, ряд інших оксидів. При відновленні ж алюмінієм Cr2O3, Nb2O5, Ta2O5, SiO2, TiO2, ZrO2, B2O3 теплоти реакції недостатньо для нагріву продуктів реакції вище їх температури плавлення.
Алюміній легко розчиняється в розбавлених мінеральних кислотах з утворенням солей. Концентрована азотна кислота, окислюючи поверхню алюмінію, сприяє потовщення і зміцнення оксидної плівки (так звана пасивація металу). Оброблений таким чином алюміній не реагує навіть з соляною кислотою. За допомогою електрохімічного анодного окислення (анодування) на поверхні алюмінію можна створити товсту плівку, яку неважко пофарбувати в різні кольори.
Витіснення алюмінієм з розчинів солей менш активних металів часто утруднено захисною плівкою на поверхні алюмінію. Ця плівка швидко руйнується хлоридом міді, тому легко йде реакція 3CuCl2 + 2Al ® 2AlCl3 + 3Cu, яка супроводжується сильним розігрівом. У міцних розчинах лугів алюміній легко розчиняється з виділенням водню: 2Al + 6NaOH + 6Н2О ® 2Na3 [Al (OH) 6] + 3H2 (утворюються і інші аніонні гідроксо-комплекси). Амфотерний характер з'єднань алюмінію проявляється також у легкому розчиненні в лугах його свіжоосадженого оксиду і гідроксиду. Кристалічний оксид (корунд) досить стійкий до дії кислот і лугів. При сплавці з лугами утворюються безводні алюмінати: Al2O3 + 2NaOH ® 2NaAlO2 + H2O. Алюмінат магнію Mg (AlO2) 2 - напівдорогоцінне каміння шпінель, зазвичай забарвлений домішками в найрізноманітніші кольори.
Бурхливе реакція алюмінію з галогенами. Якщо в пробірку з 1 мл брому внести тонку алюмінієвий дріт, то через короткий час алюміній загоряється і горить яскравим полум'ям. Реакція суміші порошків алюмінію та йоду ініціюється краплею води (вода з йодом утворює кислоту, яка руйнує оксидну плівку), після чого з'являється яскраве полум'я з клубами фіолетових парів йоду. Галогеніди алюмінія в водних розчинах мають кислу реакцію через гідролізу: AlCl3 + H2O 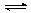 Al (OH) Cl2 + HCl.
Al (OH) Cl2 + HCl.
Реакція алюмінію з азотом йде тільки вище 800 ° С з утворенням нітриду AlN, з сірою - при 200 ° С (утворюється сульфід Al2S3), з фосфором - при 500 ° С (утворюється фосфід AlP). При внесенні в розплавлений алюміній бору утворюються бориди складу AlB2 і AlB12 - тугоплавкі сполуки, стійкі до дії кислот. Гідрид (AlH) х (х = 1,2) утворюється тільки в вакуумі при низьких температурах в реакції атомарного водню з парами алюмінію. Стійкий за відсутності вологи при кімнатній температурі гідрид AlH3 отримують в розчині безводного ефіру: AlCl3 + LiH ® AlH3 + 3LiCl. При надлишку LiH утворюється солеобразний алюмогідрид літію LiAlH4 - дуже сильний відновник, що застосовується в органічних синтезах. Водою він миттєво розкладається: LiAlH4 + 4H2O ® LiOH + Al (OH) 3 + 4H2.
Отримання алюмінію.
Документально зафіксоване відкриття алюмінію відбулося в 1825. Вперше цей метал отримав данський фізик Ганс Християн Ерстед , Коли виділив його при дії амальгами калію на безводний хлорид алюмінію (отриманий при пропущенні хлору через розпечену суміш оксиду алюмінію з вугіллям). Відігнавши ртуть, Ерстед отримав алюміній, правда, забруднений домішками. У 1827 німецький хімік Фрідріх Велер отримав алюміній у вигляді порошку відновленням гексафторалюміната калієм:
Na3AlF6 + 3K ® Al + 3NaF + 3KF. Пізніше йому вдалося отримати алюміній у вигляді блискучих металевих кульок. У 1854 французький хімік Анрі Етьєн Сент-Клер Девілль розробив перший промисловий спосіб отримання алюмінію - відновленням розплаву тетрахлоралюмініата натрієм: NaAlCl4 + 3Na ® Al + 4NaCl. Проте, алюміній продовжував залишатися надзвичайно рідкісним і дорогим металом; він коштував ненабагато дешевше золота і в 1500 разів дорожче заліза (зараз - тільки втричі). З золота, алюмінію і дорогоцінних каменів була зроблена в 1850-х брязкальце для сина французького імператора Наполеона III . Коли в 1855 на Всесвітній виставці в Парижі був виставлений великий злиток алюмінію, отриманий новим способом, на нього дивилися, як на коштовність. З дорогоцінного алюмінію зробили верхню частину (у вигляді пірамідки) пам'ятника Вашингтону в столиці США. У той час алюміній був ненабагато дешевше срібла: у США, наприклад, в 1856 він продавався за ціною 12 дол. За фунт (454 г), а срібло - по 15 дол. У виданому в 1890 1-му томі знаменитого Енциклопедичного словника Брокгауза і Ефрона говорилося, що «алюміній досі служить переважно для вичинки ... предметів розкоші». На той час у всьому світі щорічно видобувалося всього 2,5 т. Металу. Лише до кінця 19 ст., Коли був розроблений електролітичний спосіб отримання алюмінію, його щорічне виробництво почало обчислюватися тисячами тонн, а в 20 ст. - млн. Тонн. Це зробило алюміній з напівдорогоцінного широко доступним металом.
Сучасний спосіб отримання алюмінію був відкритий в 1886 молодим американським дослідником Чарлзом Мартіном Холом . Хімією він захопився ще в дитинстві. Знайшовши старий підручник хімії свого батька, він почав старанно вивчати його, а також ставити досліди, одного разу навіть отримав наганяй від матері за псування обідньої скатертини. А через 10 років він зробив видатне відкриття, що прославило його на весь світ.
Ставши в 16 років студентом, Хол почув від свого викладача, Ф.Ф.Джуетта, що якщо кому-небудь вдасться розробити дешевий спосіб отримання алюмінію, то ця людина не тільки надасть величезну послугу людству, а й заробить величезні статки. Джуетт знав, що говорив: раніше він стажувався в Німеччині, працював у Велера, обговорював з ним проблеми отримання алюмінію. З собою в Америку Джуетт привіз і зразок рідкісного металу, який показав учням. Несподівано Хол заявив привселюдно: «Я отримаю цей метал!»
Шість років тривала завзята робота. Хол намагався отримувати алюміній різними методами, але безуспішно. Нарешті, він спробував витягти цей метал електролізом. У той час електростанцій не було, ток доводилося отримувати за допомогою великих саморобних батарей з вугілля, цинку, азотної та сірчаної кислот. Хол працював в сараї, де влаштував маленьку лабораторію. Йому допомагала сестра Джулія, яка дуже цікавилася дослідами брата. Вона зберегла всі його листи і робочі журнали, які дозволяють буквально по днях простежити історію відкриття. Ось витяг з її спогадів:
«Чарлз завжди був у доброму гуморі, і навіть в найгірші дні був здатний посміятися над долею невдах винахідників. У години невдач він знаходив утіху за нашим стареньким піаніно. У своїй домашній лабораторії він працював по-багато годин без перерви; а коли він міг ненадовго залишити установку, то мчав через весь наш довгий будинок, щоб трохи пограти ... Я знала, що, граючи з таким чарівністю і почуттям, він постійно думає про свою роботу. І музика йому в цьому допомагала. »
Найважчім Було підібраті електроліт и захістіті алюміній від окислення. Через Шість місяців віснажлівої праці в тіглі, Нарешті, з'явилося кілька маленьких сріблястіх кульок. Хол негайно побіг до свого колишнього викладача, щоб розповісти про успіх. «Професор, я отримав його!», - вигукнув він, простягаючи руку: на долоні лежав десяток маленьких алюмінієвих кульок. Це сталося 23 лютого 1886. А рівно через два місяці, 23 квітня того ж року, француз Поль Еру взяв патент на аналогічне винахід, яке він зробив незалежно і майже одночасно (вражаючі і два інших збіги: і Холл, і Еру народилися в 1863 і померли в 1914).
Зараз перші кульки алюмінію, отримані Холом, зберігаються в Американської Алюмінієвої компанії в Піттсбурзі як національна реліквія, а в його коледжі коштує пам'ятник Холу, відлитий з алюмінію. Згодом Джуетт писав: «Моїм найважливішим відкриттям було відкриття людини. Це був Чарлз М.Холл, який у віці 21 року відкрив спосіб відновлення алюмінію з руди, і таким чином зробив алюміній тим чудовим металом, яким тепер широко користуються в усьому світі ». Пророцтво Джуетт збулося: Хол отримав широке визнання, став почесним членом багатьох наукових товариств. Але особисте життя йому не вдалася: наречена не хотіла змиритися з тим, що її наречений весь час проводить в лабораторії, і розірвала заручини. Хол знайшов розраду в рідному коледжі, де він пропрацював до кінця життя. Як писав брат Чарлза, «коледж був для нього і дружиною, і дітьми, і всім іншим - все його життя». Коледжу Хол заповідав і б більшу частину своєї спадщини - 5 млн. Дол. Помер Холл від лейкемії у віці 51 року.
Метод Холла дозволив отримувати за допомогою електрики порівняно недорогий алюміній у великих масштабах. Якщо з 1855 до 1890 було отримано лише 200 тонн алюмінію, то за наступне десятиліття за методом Холла у всьому світі отримали вже 28 000 т цього металу! До 1930 світове щорічне виробництво алюмінію досягло 300 тис. Тонн. Зараз же щорічно отримують понад 15 млн. Т. Алюмінію. У спеціальних ваннах при температурі 960-970 ° С піддають електролізу розчин глинозему (технічний Al2O3) в розплавленому кріоліті Na3AlF6, який частково добувають у вигляді мінералу, а частково спеціально синтезують. Рідкий алюміній накопичується на дні ванни (катод), кисень виділяється на вугільних анодах, які поступово обгорають. При низькій напрузі (близько 4,5 В) електролізери споживають величезні струми - до 250 000 А! За добу один електролізер дає близько тонни алюмінію. Виробництво вимагає великих витрат електроенергії: на отримання 1 тонни металу витрачається 15000 кіловат-годин електроенергії. Така кількість електрики споживає великий 150-квартирний будинок протягом цілого місяця. Виробництво алюмінію екологічно небезпечно, так як атмосферне повітря забруднюється летючими сполуками фтору.

Застосування алюмінію.
Ще Д. І. Менделєєв писав, що «металевий алюміній, володіючи великою легкістю і міцністю і малою мінливістю на повітрі, дуже придатний для деяких виробів». Алюміній - один з найпоширеніших і дешевих металів. Без нього важко уявити собі сучасне життя. Недарма алюміній називають металом 20 століття. Він добре піддається обробці: кування, прокату, волочіння, пресування. Чистий алюміній - досить м'який метал; з нього роблять електричні дроти, деталі конструкцій, фольгу для харчових продуктів, кухонне начиння і «срібну» фарбу. Цей красивий і легкий метал широко використовують в будівництві і авіаційній техніці. Алюміній дуже добре відбиває світло. Тому його використовують для виготовлення дзеркал - методом напилення металу у вакуумі.
У авіа- і машинобудуванні, при виготовленні будівельних конструкцій, використовують значно більше тверді сплави алюмінію. Один з найвідоміших - сплав алюмінію з міддю і магнієм (дуралюмин, або просто «дюраль», назва яких походить від німецького міста Дюрена). Цей сплав після гарту набуває особливої твердість і стає приблизно в 7 разів міцніше чистого алюмінію. У той же час він майже втричі легше заліза. Його отримують, сплавляючи алюміній з невеликими добавками міді, магнію, марганцю, кремнію та заліза. Широко поширені силуміни - ливарні сплави алюмінію з кремнієм. Виробляються також високоміцні, криогенні (стійкі до морозів) і жароміцні сплави. На вироби з алюмінієвих сплавів легко наносяться захисні і декоративні покриття. Легкість і міцність алюмінієвих сплавів особливо знадобилися в авіаційній техніці. Наприклад, зі сплаву алюмінію, магнію і кремнію роблять гвинти вертольотів. Порівняно дешева алюмінієва бронза (до 11% Al) має високі механічні властивості, вона стійка в морській воді і навіть в розведеної соляної кислоти. З алюмінієвої бронзи в СРСР з 1926 по 1957 карбувалися монети номіналом 1, 2, 3 і 5 копійок.
В даний час четверта частина всього алюмінію йде на потреби будівництва, стільки ж споживає транспортне машинобудування, приблизно 17% частина витрачається на пакувальні матеріали і консервні банки, 10% - в електротехніці.
Алюміній містять також багато горючі і вибухові суміші. Алюмотол, лита суміш тринітротолуолу з порошком алюмінію, - одне з найпотужніших промислових вибухових речовин. Амонал - вибухова речовина, що складається з аміачної селітри, тринітротолуолу і порошку алюмінію. Запальні суміші містять алюміній і окислювач - нітрат, перхлорат. Піротехнічні склади «Зірочки» також містять порошкоподібний алюміній.
Суміш порошку алюмінію з оксидами металів (терміт) застосовують для одержання деяких металів і сплавів, для зварювання рейок, в запалювальних боєприпасах.
Алюміній знайшов також практичне застосування в якості ракетного палива. Для повного спалювання 1 кг алюмінію потрібно майже вчетверо менше кисню, ніж для 1 кг гасу. Крім того, алюміній може окислюватися не тільки вільним киснем, а й пов'язаним, що входять до складу води або вуглекислого газу. При «згорянні» алюмінію у воді на 1 кг продуктів виділяється 8800 кДж; це в 1,8 рази менше, ніж при згорянні металу в чистому кисні, але в 1,3 рази більше, ніж при згорянні на повітрі. Значить, як окислювач такого палива можна використовувати замість небезпечних і дорогих з'єднань просту воду. Ідею використання алюмінію в якості пального ще в 1924 запропонував вітчизняний вчений і винахідник Ф. А. Цандер. За його задумом можна використовувати алюмінієві елементи космічного корабля в якості додаткового пального. Цей сміливий проект поки практично не здійснено, зате більшість відомих в даний час твердих ракетних палив містять металевий алюміній у вигляді тонкоизмельченного порошку. Додавання 15% алюмінію до палива може на тисячу градусів підвищити температуру продуктів згоряння (з 2200 до 3200 К); помітно зростає і швидкість витікання продуктів згоряння з сопла двигуна - головний енергетичний показник, що визначає ефективність ракетного палива. В цьому плані конкуренцію алюмінію можуть скласти тільки літій, берилій і магній, але всі вони значно дорожче алюмінію.
Широке застосування знаходять і з'єднання алюмінію. Оксид алюмінію - вогнетривкий і абразивний (наждак) матеріал, сировину для отримання кераміки. З нього також роблять лазерні матеріали, підшипники для годин, ювелірні камені (штучні рубіни). Прожарений оксид алюмінію - адсорбент для очищення газів і рідин і каталізатор ряду органічних реакцій. Безводний хлорид алюмінію - каталізатор в органічному синтезі (реакція Фріделя - Крафтса), вихідна речовина для отримання алюмінію високої чистоти. Сульфат алюмінію застосовують для очищення води; реагуючи з вмісту в ній гідрокарбонатом кальцію:
Al2 (SO4) 3 + 3Ca (HCO3) 2 ® 2AlO (OH) + 3CaSO4 + 6CO2 + 2H2O, він утворює пластівці оксиду-гідроксиду, які, осідаючи, захоплюють, а також сорбують на поверхні знаходяться у воді зважені домішки і навіть мікроорганізми. Крім того, сульфат алюмінію застосовують як протравлення при фарбуванні тканин, для дублення шкіри, консервування деревини, проклеювання паперу. Алюмінат кальцію - компонент в'яжучих матеріалів, в тому числі портландцементу. Ітрій-алюмінієвий гранат (ІАГ) YAlO3 - лазерний матеріал. Нітрид алюмінію - вогнетривкий матеріал для електропечей. синтетичні цеоліти (Вони відносяться до алюмосилікатів) - адсорбенти в хроматографії і каталізатори. Алюмінійорганіческіх з'єднання (наприклад, тріетілалюміній) - компоненти каталізаторів Циглера - Натта, які використовуються для синтезу полімерів, в тому числі синтетичного каучуку високої якості.
Ілля Леенсон
Чи могли древні отримати вільний алюміній?Чи могли в давнину знайти самородний алюміній, як, наприклад, самородки золота, срібла, міді?













