- Реакція сахарози з водою [ правити | правити код ]
- Реакція сахарози з гідроксидом міді (II) [ правити | правити код ]
- Природні і антропогенні джерела [ правити | правити код ]
open wikipedia design.
Ця стаття - про хімічну речовину. Про харчовому продукті см. цукор . сахароза 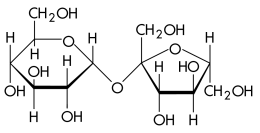
 систематичне
систематичне
найменування (2R, 3R, 4S, 5S, 6R) -2 - [(2S, 3S, 4S, 5R) -3,4-дигідрокси-2,5-біс (гідроксиметил) оксолан-2-іл] окси-6 ( гидроксиметил) оксан-3,4,5-тріол Традиційні назви α-D-глюкопіраноз-β-D-фруктофуранозід, буряковий цукор, тростинний цукор Хім. формула C12H22O11 стан Тверда, кристалічна молярна маса 342,2965 ± 0,0144 г / моль щільність 1,587 г / см³ Т. плав. 186 ° C 367 ± 1 ° F [1] і 320 ± 1 ° F [1] Тиск пари 0 ± 1 мм рт.ст. [1] розчинність в воді 211,5 г / 100 мл Реєстр. номер CAS 57-50-1 PubChem 5988 Реєстр. номер EINECS 200-334-9 SMILES InChI RTECS WN6500000 ChEBI 17992 ChemSpider 5768 Наводяться дані для стандартних умов (25 ° C, 100 кПа) , Якщо не вказано іншого.
Сахароза (цукроза, тростинний цукор) C12H22O11, в побуті просто цукор , - дисахарид з групи олигосахаридов , Що складається з двох моносахаридів : α- глюкози і β- фруктози .
Сахароза є досить поширеним в природі дисахаридом. Вона зустрічається в багатьох фруктах , плодах і ягодах . Особливо великий зміст сахарози в цукровому буряці і цукровій тростині , Які і використовуються для промислового виробництва харчового цукру.
Сахароза, потрапляючи в кишечник , швидко гідролізується альфа-глюкозидази тонкої кишки на глюкозу і фруктозу, які потім всмоктуються в кров . інгібітори альфа-глюкозидази , такі як акарбоза , Гальмують розщеплення і всмоктування сахарози, а також і інших вуглеводів , Гідролізуемих альфа-глюкозидази, зокрема, крохмалю . Це використовується в лікуванні цукрового діабету 2-го типу [2] .
У чистому вигляді - безбарвні моноклінні кристали. При застиганні розплавленої сахарози утворюється аморфна прозора маса - карамель. Сахароза має високу розчинність. Розчинність (в грамах на 100 грам розчинника): у воді 179 (0 ° C) і 487 (100 ° C), в етанолі 0,9 (20 ° C). Малорастворима в метанолі. Чи не розчинна в діетиловому ефірі . Щільність 1,5879 г / см3 (15 ° C). Питоме обертання для D-лінії натрію: 66,53 (вода; 35 г / 100г 20 ° C). Температура плавлення 186 ℃.
Чи не проявляє відновлюють властивостей - не реагує з реактивами Толленса , Фелінга і Бенедикта . Не утворює відкриту форму, тому не проявляє властивостей альдегідів і кетонів . Наявність гідроксильних груп в молекулі сахарози легко підтверджується реакцією з гідроксидами металів. Якщо розчин сахарози долити до гідроксиду міді (II), утворюється яскраво-синій розчин сахарата міді. Альдегідної групи в сахарозі немає: при нагріванні з аміачним розчином оксиду срібла (I) вона не дає реакцію «срібного дзеркала», при нагріванні з гідроксидом міді (II) не утворює червоного оксиду міді (I). З числа ізомерів сахарози, що мають молекулярну формулу С12Н22О11, можна виділити мальтозу і лактозу .
Реакція сахарози з водою [ правити | правити код ]
Якщо прокип'ятити розчин сахарози з декількома краплями соляної або сірчаної кислоти і нейтралізувати кислоту лугом, а після цього нагріти розчин, то з'являються молекули з альдегідні групами, які і відновлюють гідроксид міді (II) до оксиду міді (I). Ця реакція показує, що сахароза при каталітичному дії кислоти піддається гідролізу , В результаті чого утворюються глюкоза і фруктоза :
C 12 H 22 O 11 + H 2 O → C 6 H 12 O 6 + C 6 H 12 O 6 {\ displaystyle {\ mathsf {C_ {12} H_ {22} O_ {11} + H_ {2} O \ rightarrow C_ {6} H_ {12} O_ {6} + C_ {6} H_ {12} O_ {6}}}}
Реакція сахарози з гідроксидом міді (II) [ правити | правити код ]
У молекулі сахарози є кілька гідроксильних груп. Тому з'єднання взаємодіє з гідроксидом міді (II) аналогічно гліцерину і глюкози. При додаванні розчину сахарози до осаду гідроксиду міді (II) він розчиняється; рідина забарвлюється в синій колір. Але, на відміну від глюкози, сахароза не відновлює гідроксид міді (II) до оксиду міді (I).
Природні і антропогенні джерела [ правити | правити код ]
міститься в цукровій тростині , цукровому буряці (До 28% сухої речовини), соках рослин і плодах (наприклад, берези, клена, дині та моркви). Джерело отримання сахарози - з буряка або з тростини, визначають по співвідношенню змісту стабільних ізотопів вуглецю 12C і 13C. Цукровий буряк має C3-механізм засвоєння вуглекислого газу (через фосфогліцеріновую кислоту ) І переважно поглинає ізотоп 12C; цукрова тростина має C4-механізм поглинання вуглекислого газу (через щавлевооцтову кислоту ) І переважно поглинає ізотоп 13C.
Світове виробництво в 1990 році - 110 000 000 тон.
Статичне 3D-зображення
молекули сахарозикристали коричневого
(Нерафінованої тростинного) цукру













