Біополе е ри, високомолекулярні природні сполуки, що є структурною, основою всіх живих організмів і відіграють визначальну роль в процесах життєдіяльності. До Б. відносяться білки, нуклеїнові кислоти і полісахариди; відомі також змішані Б. - глікопротеїди, ліпопротеїди, гліколіпіди і ін.
Біологічні функції Б. нуклеїнові кислоти виконують в клітці генетичні функції. Послідовність мономірних ланок (нуклеотидів) у дезоксирибонуклеїнової кислоти - ДНК (іноді в рибонуклеїнової кислоти - РНК) визначає (у формі генетичного коду ) Послідовність мономірних ланок (амінокислотних залишків) у всіх білках, що синтезуються і, т. О., Будова організму і що протікають в ньому біохімічні процеси. При розподілі кожної клітини обидві дочірні клітини отримують повний набір генів завдяки попередньому Самоудвоение ( реплікації ) Молекул ДНК. Генетична інформація з ДНК переноситься на РНК, що синтезується на ДНК як на матриці ( транскрипція ). Ця т. Н. інформаційна РНК (і-РНК) служить матрицею при синтезі білка, що відбувається на особливих органелах клітини - рибосомах ( трансляція ) За участю транспортної РНК (т-РНК). Біологічна мінливість, необхідна для еволюції, здійснюється на молекулярному рівні за рахунок змін в ДНК (див. мутація ).
білки виконують в клітці ряд найважливіших функцій. Білки-ферменти здійснюють всі хімічні реакції обміну речовин в клітині, проводячи їх в необхідній послідовності і з потрібною швидкістю. Білки м'язів, джгутиків мікробів, клітинних ворсинок і ін. Виконують скоротливу функцію, перетворюючи хімічну енергію в механічну роботу і забезпечуючи рухливість організму в цілому або його частин. Білки - основний матеріал більшості клітинних структур (в т. Ч. В спеціальних видах тканин) всіх живих організмів, оболонок вірусів і фагів. Оболонки клітин є ліпопротеїдними мембранами, рибосоми побудовані з білка і РНК і т.д. Структурна функція білків тісно пов'язана з регуляцією надходження різних речовин в субклітинні органели ( активний транспорт іонів і ін.) і з ферментативним каталізом. Білки виконують і регуляторні функції ( репрессори ), «Забороняючи» або «вирішуючи» прояв того чи іншого гена. У вищих організмах є білки - переносники тих чи інших речовин (наприклад, гемоглобін - переносник молекулярного кисню) і імунні білки, які захищають організм від чужорідних речовин, проникаючих в організм (див. імунітет ). полісахариди виконують структурну, резервну і деякі інші функції. Білки і нуклеїнові кислоти утворюються в живих організмах шляхом матричного ферментативного біосинтезу . Є тепер і біохімічні системи позаклітинного синтезу Б. за допомогою ферментів, виділених з клітин. Розроблено методи хімічного синтезу білків і нуклеїнових кислот.
Первинна структура Б. Склад і послідовність мономірних ланок Б. визначають їх т. Н. первинну структуру. Всі нуклеїнові кислоти є лінійними гетерополімера - сахарофосфатнимі ланцюжками, до ланкам яких приєднані бічні групи - азотисті основи: аденін і тимін (в РНК - урацил), гуанін і цитозин; в деяких випадках (головним чином в т-РНК) бічні групи можуть бути представлені іншими азотистими підставами. Білки - також гетерополімери; молекули їх утворені однією або декількома поліпептидними ланцюжками, сполученими дисульфідними містками. До складу поліпептидних ланцюгів входить 20 видів різних мономірних ланок - залишків амінокислот. Молекулярна маса ДНК варіює від декількох млн. (У дрібних вірусів і бактеріофагів) до ста млн. І більше (у більших фагів); бактеріальні клітини містять по одній молекулі ДНК з молекулярною масою в кілька млрд. ДНК вищих організмів може мати і велику молекулярну масу, але виміряти її поки не вдалося через розриви в молекулах ДНК, що виникають при їх виділенні. Хвороби мають молекулярну масу від 600 тис. До 1,1 млн., Інформаційна (і-РНК) - від сотень тисяч до декількох мільйонів, транспортна (т-РНК) - близько 25 тис. Молекулярна маса білків варіює від 10 тис. ( і менш) до мільйонів; в останньому випадку, однак, зазвичай можливе розділення білкової частки на субодиниці, сполучені між собою слабкими, переважно гідрофобними, зв'язками.
Конформація, т. Е. Та чи інша просторова форма молекул Б., визначається їх первинною структурою. Залежно від хімічної будови і зовнішніх умов молекули Б. можуть знаходитися або в одній або в декількох переважних конформаціях (зазвичай зустрічаються в природних умовах нативні стану Б .: наприклад, Глобулярна будова білків, подвійна спіраль ДНК), або приймати багато більш-менш рівноімовірні конформації. Білки ділять по просторовій структурі на фібрилярні (ниткоподібні) і глобулярні; білки-ферменти, білки-переносники, імунні і деякі інші мають, як правило, глобулярную структуру. Для ряду білків - гемоглобін, міоглобін, лізоцим, рибонуклеаза та ін. - ця структура встановлена у всіх деталях (з визначенням за допомогою рентгеноструктурного аналізу розташування кожного атома). Вона визначається послідовністю амінокислотних залишків і утворюється і підтримується відносно слабкими взаємодіями між мономірні ланками поліпептидних ланцюгів в водно-сольовому розчині (кулонівських і дипольні сили, водневі зв'язки, гідрофобні взаємодії), а також дисульфідними зв'язками. Глобула білка формується так, що більшість полярних гідрофільних амінокислотних залишків виявляється зовні і контактує з розчинником, а більшість неполярних (гідрофобних) залишків знаходиться всередині і ізольовано від взаємодії з водою. Молекули білка, що володіють надлишком неполярних груп, коли частина з них виявляється на поверхні глобули, утворюють вищу, т. Н. четвертинних структуру, при якій кілька глобул агрегує, взаємодіючи між собою в основному неполярними ділянками (рис. 1). Просторова структура кожного білка-ферменту унікальна і забезпечує необхідне для його функціонування розташування в просторі всіх ланок Б., особливо т. Зв. активних центрів . У той же час вона не абсолютно жорстка і допускає необхідні в процесі функціонування (при взаємодії з субстратами, інгібіторами і іншими речовинами) конформаційні зрушення і зміни.
Просторова структура нативної ДНК утворена двома комплементарними нитками і являє собою подвійну спіраль Крику - Уотсона; в ній протилежні азотисті основи попарно зв'язані водневими зв'язками - аденін з тиміном і гуанін з цитозином. Стійкість подвійної спіралі забезпечується, поряд з водневими зв'язками, також гідрофобною взаємодією між плоскими кільцями азотистих основ, розташованих стопкою (пакетний взаємодія, або стакінг). Нитки РНК спіралізують лише частково. ДНК вірусів, бактеріофагів, бактерій, а також мітохондріальна у ряді випадків є замкнутим кільцем; при цьому поряд зі спіраллю Крику - Уотсона спостерігається ще додаткова т. н. сверхспіралізаціі.
Денатурація Б. Порушення нативної просторової структури Б. при різних впливах (підвищення температури, зміна концентрації металів, кислотності розчину і ін.) Називається денатурацією і в ряді випадків можна зупинити (зворотний процес називається ренатурацією; рис. 2). Молекули Б. - кооперативні системи: поведінка їх залежить від взаємодій складових частин. Кооперативность молекул Б. визначається тим, що повороти окремих ланок через внутрішньо молекулярних взаємодії залежать від конформації сусідніх ланок. В основі денатурації Б. при зміні зовнішніх умов зазвичай лежать кооперативні конформаційні перетворення (наприклад, переходи a-спіраль - b -Структура, a-спіраль - клубок, b -Структура - клубок для поліпептидів, перехід кулька - клубок для глобулярних білків, перехід спіраль - клубок для нуклеїнових кислот). На відміну від фазових переходів (кипіння рідини, плавлення кристала), що є граничним випадком кооперативних процесів і що відбуваються стрибком, кооперативні переходи Б. здійснюються в кінцевому, хоча і порівняно вузькому, інтервалі змін зовнішніх умов. У цьому інтервалі одновимірні, лінійні молекули (нуклеїнові кислоти, поліпептиди), що зазнають перехід спіраль - клубок, розбиваються на чергуються спіральні і клубкообразние ділянки (рис. 3).
Перехід спіраль - клубок в ДНК спостерігається при підвищенні температури, додаванні в розчин кислоти або лугу, а також під впливом інших денатуруючих агентів. Цей перехід в гомополінуклеотідах відбувається при нагріванні в інтервалі десятих часток ° С, в фагових і бактеріальних ДНК - в інтервалі 3-5 ° С (рис. 3), в ДНК вищих організмів - в інтервалі 10-15 ° С. Чим вище гетерогенність ДНК, тим ширше інтервал переходу і менше здатність молекул ДНК до ренатурації. Перехід спіраль - клубок в різних видах РНК носить менш кооперативний характер (рис. 4) і відбувається в ширшому інтервалі температурних або інших денатуруючих впливів.
Б. - полімерні електроліти, їх просторова конформація і кооперативні переходи залежать як від ступеня іонізації молекули, так і від концентрації іонів в середовищі, що впливає на електростатичні взаємодії як між окремими частинами молекули, так і між Б. і розчинником.
Будова і біологічні функції Б. Будова Б. - результат тривалої еволюції на молекулярному рівні, внаслідок чого ці молекули ідеально пристосовані до виконання своїх біологічних завдань. Між первинною структурою, конформацией Б. і конформаційними переходами, з одного боку, і їх біологічними функціями - з іншого, існують тісні зв'язки, дослідження яких - одне з головних завдань молекулярної біології . Встановлення таких зв'язків в ДНК дозволило зрозуміти основні механізми реплікації , транскрипції і трансляції , а також мутагенезу і деяких інших найважливіших біологічних процесів. Лінійна структура молекули ДНК забезпечує запис генетичної інформації, її подвоєння при матричному синтезі ДНК і отримання (також шляхом матричного синтезу) багатьох копій з одного і того ж гена, т. Е. Молекул і-РНК. Сильні ковалентні зв'язки між нуклеотидами забезпечують збереження генетичної інформації при всіх цих процесах. У той же час відносно слабкі зв'язки між нитками ДНК і можливість обертання навколо простих хімічних зв'язків забезпечують гнучкість і лабільність просторової структури, необхідні для поділу ниток при реплікації і транскрипції, а також рухливість молекули і-РНК, що служить матрицею при біосинтезі білка (трансляція). Дослідження просторової структури і конформаційних змін білків-ферментів на різних стадіях ферментативної реакції при взаємодії з субстратами і коферментами дає можливість встановити механізми биокатализа і зрозуміти природу величезного прискорення хімічних реакцій, здійснюваного ферментами.
Методи дослідження Б. При дослідженні будови і конформаційних перетворень Б. широко використовуються як очищені природні Б., так і їх синтетичні моделі, які простіше по будові і легше піддаються дослідженню. Так, при вивченні білків моделями служать гомогенні або гетерогенні поліпептиди (із заданим або випадковим чергуванням амінокислотних залишків). Моделями ДНК і РНК є відповідні синтетичні гомогенні або гетерогенні полінуклеотіди. До методів дослідження Б. і їх моделей відносяться рентгеноструктурний аналіз, електронна мікроскопія, вивчення спектрів поглинання, оптичної активності, люмінесценції, методи светорассеяния і динамічного подвійного променезаломлення, новий метод, віскозиметрія, фізико-хімічні методи розділення і очищення і ряд ін. Всі методи, розроблені для вивчення синтетичних полімерів, застосовні і до Б. При трактуванні властивостей Б. і їх моделей, закономірностей їх конформаційних перетворень використовуються також методи теоретичної фі ики (статистичної фізики, термодинаміки, квантової механіки і ін.).
Літ .: Бреслер С. Е., Введення в молекулярну біологію, М.-Л., 1966; Волькенштейн М. В., Молекули і життя, М., 1965; Уотсон Дж., Молекулярна біологія гена, пер. з англ., М., 1967; фізичні методи дослідження білків і нуклеїнових кислот, М., 1967.
Ю. С. Лазуркін.
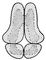
Мал. 1. Утворення четвертинної структури глобулярних білків. Заштриховані рідко - полярні (гідрофільні) частини білкових глобул, густо - неполярні (гідрофобні) області.
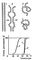
Мал. 3. Схема переходу спіраль - клубок для ДНК: 1 - нативное стан (замість подвійної спіралі для простоти зображена «мотузкові сходи»); 2 - стан ДНК у області переходу; 3 - денатуровані стан (однонітевиє клубки).
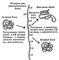
Мал. 2. Схема денатурації і ренатурації глобулярного білка (на прикладі ферменту рибонуклеази).













