Антибіотики прямо під нашим носом
Андрій Панов, «Біомолекул»
Німецькі вчені виявили нову зброю для боротьби з лікарняними монстром - мультирезистентний золотистим стафілококом. Довгі роки воно ховалося не в вічній мерзлоті або Маріанської западини, а прямо під нашим носом. Вірніше - в ньому.
В останні роки в усьому світі збільшилася кількість інфекційних захворювань, викликаних стійкими до антибіотиків бактеріями. Організми з множинною лікарською резистентністю (multidrug-resistant organisms, MDRO), такі як метицилін-резистентний золотистий стафілокок, нечутливі до ванкоміцину ентерококи або резистентні до цефалоспоринів третього покоління грамнегативнібактерії, в найближчі десятиліття можуть стати більш частими причинами смерті, ніж рак [1] .
Доступні населенню антибіотики втрачають ефективність, а їх часте і необґрунтоване застосування призводить до відбору стійких форм бактерій всередині організмів людей і тварин. MDRO в людському мікробіома важко виявити, адже зазвичай їх носійство безсимптомно. Однак в стресових умовах (після хірургічних операцій, при травмах або імуносупресії) воно може перерости в агресивну інфекцію, побороти яку буде вкрай складно. А якщо ще врахувати і часту стійкість подібних бактерій до класичних дезінфектантів, стає зрозумілим, чому MDRO вважають справжнім бичем стаціонарів і пологових будинків. Вони - куди більш відчутна загроза для населення всіх континентів, ніж той же вірус Ебола, тому величезні зусилля зараз направляються на пошук і виробництво нових антибіотиків, здатних «зламати» захисні системи MDRO.
Кілька років тому вдалося виявити, що представники людської мікробіоти здатні виробляти бактеріоцини, що вражають близькоспоріднених бактерій [2]. Наприклад, в 2014 році з людського комменсала Lactobacillus gasseri виділили і описали новий синтезується рибосомами тіопептідний антибіотик - лактоціллін [3].
Про пептидних антибіотиках «біомолекул» докладно розповідала раніше: «Антимікробні пептиди - можлива альтернатива традиційних антибіотиків» [4].
Може здатися дивним, що людська мікробіота виробляє антибіотики, адже індустрія пошуку протимікробних речовин завжди була зосереджена на ґрунтових бактеріях: вважалося, що саме там вирує життя і активно йде боротьба за існування. Однак в мікробіома людини налічується понад тисячу видів бактерій, що конкурують за місце і поживні речовини. Це сприяє появі справжнього «зброї масового ураження» - бактеріоцинів, вироблених за допомогою ферментів двох типів - полікетідсінтаз і нерібосомних пептідсінтетаз [5].
сімейні розбірки
Німецький дослідник Олександр Ціпперер зі своїми співробітниками в липні 2016 року повідомив про те, що виявив в людському носі бактерію Staphylococcus lugdunensis IVK28, яка пригнічує ріст метицилін-резистентного золотистого стафілокока (methicillin-resistant Staphylococcus aureus, MRSA) [1].
золотистий стафілокок
Стафілококи відносяться до типових бактеріям-комменсалам, колонізує шкіру і поверхні слизових оболонок. Staphylococcus aureus - кулясті грампозитивні бактерії, що виробляють каротиноїдний пігмент, який надає їх клітинам золотистий колір (рис. 1). Ці мікроорганізми надзвичайно стійкі до зовнішніх впливів і виживають в повітрі, пилу, грунті, продуктах харчування, на обладнанні харчових виробництв і предметах побуту [6, 7].
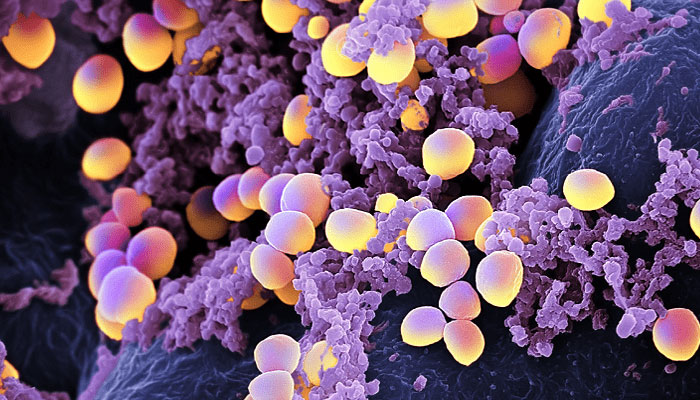
Малюнок 1. Staphylococcus aureus і лейкоцити. Малюнок з сайту relatedscience.blogspot.ru.
Staphylococcus aureus - бактерія умовно-патогенна, що проявляє свої патологічні властивості тільки в сприятливих умовах, а створює їх, як правило, ослаблення імунітету носія. Активна життєдіяльність стафілокока може привести до різноманітних захворювань [5, 7, 8]:
- шкіри (прищі, фурункули, синдром ошпареної шкіри);
- органів дихання (плеврит, пневмонія);
- кісткової і сполучної тканин (артрит, остеомієліт);
- нервової системи та органів чуття (отит, менінгіт);
- серцево-судинної системи (ендокардит, флебіт, стафілококова бактеріємія).
Фактори патогенності S.aureus - це мікрокапсула, компоненти клітинної стінки, ферменти агресії і токсини. Мікрокапсули захищають клітини бактерій від фагоцитозу, сприяють їх адгезії і поширенню по організму господаря. Складові клітинної стінки (наприклад пептидогликан, тейхоевие кислоти і білок А) викликають розвиток запалення, обездвиживают фагоцити і нейтралізують імуноглобуліни. Коагулаза, головний фермент агресії, викликає згортання плазми крові [7, 9].
Найбільш небезпечні метицилін-резистентні стафілококи (methicillin-resistant S.aureus, MRSA) (рис. 2). Метицилін - це модифікований пеніцилін, за допомогою якого ще недавно успішно боролися зі стафілококової інфекцією. MRSA стійкі не тільки до метициліну, а й до інших антибіотиків пеніцилінової групи (діклоксаціллін, оксациллину, нафциллин і ін.), А також до цефалоспоринів.
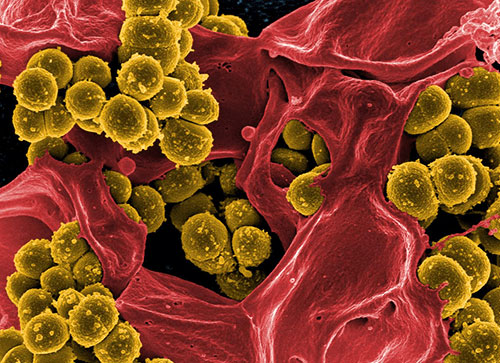
Малюнок 2 (з сайту thinglink.com). Метицилін-резистентні золотисті стафілококи.
Останнім часом виявлені штами і з більш широким спектром стійкості: ванкоміцин-резистентні (VRSA) і глікопептид-резистентні (GISA) [6, 9, 10].
Основні джерела зараження золотистим стафілококом - хворі зі стертою формою інфекції і безсимптомні носії. Найбільша небезпека виходить від медичного персоналу: за деякими даними, носійство серед медиків може досягати 35% і, в порівнянні з основною популяцією, вони набагато частіше «населені» антибіотикорезистентних штамами. S.aureus може передаватися через руки медперсоналу і нестерильні медичні інструменти, при використанні внутрішньовенних катетерів і проведенні штучної вентиляції легенів. Після госпіталізації носіями золотистих стафілококів стають 20-30% пацієнтів, що приймали антибіотики, хворих на цукровий діабет або проходили гемодіаліз [7, 10]. У тому числі тому грамотні лікарі закликають обдумано підходити до госпіталізації - вдаватися до неї тільки в разі реальної необхідності і виписуватися якомога швидше. Крім стафілокока і інших потенційно мультирезистентних бактерій, серед пацієнтів, відвідувачів і персоналу там блискавично поширюються дуже неприємні віруси - рота- і норо-, тільки ось попереджати про внутрішньолікарняних спалахах «туалетних» інфекцій рідко де вважають за потрібне. Тому «піти полежати для профілактики, прокáпаться» може обернутися трохи несподіваним боком ...
Штам S.lugdunensis IVK28 ефективно боровся зі своїм шкідливим родичем лише в умовах нестачі заліза і тільки на твердих щільних середовищах (рис. 3, зліва). Механізм протистояння був неясний, а тому Ціпперер провів транспозонового мутагенезу клітин виділеного штаму - щоб виявити ген, відповідальний за синтез смертельного для S.aureus речовини.
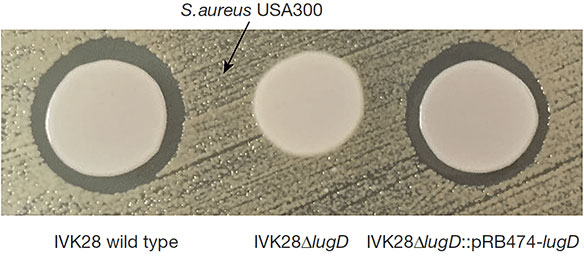
Малюнок 3. Антибактеріальна активність S.lugdunensis проти метицилін-резистентного S.aureus. Зліва - дикий штам IVK28 утворює зону лізису на культурі S.aureus. У центрі - штам IVK28ΔlugD (з «вимкненим» встраиванием транспозона геном lugD) не впливає на золотистого стафілокока. Праворуч - штам з відновленої активністю гена lugD знову лизирует клітини конкурента. Малюнок з [1].
В результаті вдалося отримати мутанта IVK28, який не міг пригнічувати ріст MRSA. Аналіз місця вмонтування транспозона показав, що той порушив структуру гена передбачуваної нерібосомной пептідсінтетази (НРПС). Виявилося, що цей ген разом з іншими послідовностями, пов'язаними з біосинтезу антибіотиків, входить до складу оперона розміром 30 т.п.н. Це вказувало на те, що передбачувана молекула інгібітора може бути комплексом нерібосомних пептидів.
Оперон методом ПЛР виявили у всіх культурах S.lugdunensis, а значить, він характерний для всього виду, а не тільки для штаму IVK28. Однак GC-складу оперона (26,9%) відрізнявся від GC-складу іншого генома S.lugdunensis (33,8%), що свідчило про можливе запозичення цього корисного генетичного кластера у інших видів бактерій - шляхом горизонтального переносу.
Різношерсті учасники і пікантні подробиці бактеріального горизонтального генетичного переносу описані в статті «Мобільні генетичні елементи прокаріотів: стратифікація" суспільства "бродяжок і домосідів» [11].
Оперон складається з генів lugA, B, C і D, що кодують пептідсінтетазние білки (див. Врізку нижче), а також з інших генів, чиї продукти необхідні для синтезу і транспорту нерібосомного пептиду.
Щоб остаточно поставити оперон участь в антибактеріальної діяльності S.lugdunensis, найменший ген (lugD) видалили. Мутант ΔlugD, як і очікувалося, не міг пригнічувати ріст золотистого стафілокока, але коли в нього ввели плазмиду з працюючим геном lugD, агресивний фенотип відновився (рис. 3, в центрі і справа).
секретна зброя
Виділений Ціпперером продукт lug-оперона виявився нерібосомним циклічним пептидом, що складається з п'яти амінокислот (двох D-валін, L-валін, D-лейцину і L-триптофану) і тиазолидинового гетероциклу (рис. 4). Назвали антибіотик лугдуніном.

Малюнок 4. Кластер генів, біосинтетичний шлях і хімічна структура лугдуніна. а - Гени «субодиниць" (не модулів!) нерібосомной пептідсінтетази S.lugdunensis: lugA, B, C і D. б - Функціональні домени продуктів оперона: А - аденілірующій, Р - пептідільний, С - конденсирующий, Е - епімерізующій, R - редуктазної. Їх специфічні комбінації складають модулі - відокремлені каталітичні одиниці ферменту. Біосинтез лугдуніна починається, мабуть, в ініціюванні модулі LugD і триває послідовно за допомогою LugA-C. в - Структурна формула лугдуніна. Малюнок з [1].
Хімічним синтезом вдалося отримати продукт з ідентичними природному лугдуніну хімічними властивостями і антибактеріальним ефектом. Вчені припустили, що цей антибіотик пригнічує синтез бактеріальних біополімерів - білків, ДНК і пептідогліканов [5].
Нерібосомние пептиди
Цей клас пептидів синтезується в клітинах нижчих грибів і бактерій без участі рибосом. Нерібосомние пептиди (НРП) також зустрічаються і у вищих організмів, які мають бактерій-комменсалов [12].
НРП поділяються на кілька функціональних груп [13]:
- антибіотики (ванкоміцин);
- попередники антибіотиків (ACV-трипептид - попередник пеніциліну і цефалоспорина);
- імуносупресори (циклоспорин);
- протипухлинні пептиди (блеоміцин);
- сідерофори (піовердін);
- токсини (HC-токсин);
- сурфактанти (сурфактін).
будова
Нерібосомние пептиди мають довжину від 2 до 50 амінокислот і часто циклічну або розгалужену структуру. Вони містять як «звичайні», Протеїногенні, так і непротеіногенние амінокислоти - D-форми або залишки, модифіковані приєднанням N-метильних і N-формільних груп, глікозилюванням, гідроксилюванням, ацилированием або галогенированием. Циклизация відбувається шляхом утворення в пептидному кістяку оксазолінов і тіазолінов [12].
синтез
НРП синтезуються нерібосомнимі пептідсінтетазамі (НРПС), які в своїй роботі не йдуть «чужим» інструкціям, тобто обходяться без мРНК. НРПС - це гігантські мультимодульних ферменти, кожен з яких може синтезувати тільки один вид пептидів. Окремий модуль ферменту відповідає за включення однієї амінокислоти в пептидную ланцюг, тому кількість модулів відповідає довжині пептиду [14].
Кожен модуль складається як мінімум з трьох доменів:
- конденсирующего (приймає пептидную ланцюг з попереднього модуля);
- аденілірующего (вибирає потрібну амінокислоту);
- пептідільний (утворює пептидний зв'язок).
Нерідко модулі включають і інші домени, в тому числі епімерізующій, який перетворює L-амінокислоти в D-форми [14].
За аналогією з тріплетним рибосомні кодом для синтезу білка існує і нерібосомний, код НРПС, який визначається 10 залишками амінокислот в субстрат-зв'язує кишені аденілірующего домену. Від комбінації цих залишків залежить те, яка амінокислота буде вбудована в пептид конкретним модулем НРПС. Знаючи цей код, можна прогнозувати субстратне специфічність аденілірующіх доменів і навіть довільно змінювати її за допомогою заміни амінокислот в домені [14].
В експериментах німецьких вчених лугдунін діяв не тільки на метицилін-резистентних стафілококів, але і на глікопротеїн-резистентних, і навіть на інших грампозитивних бактерій типу лістерії і ванкоміцин-резистентного ентерококка (табл. 1). Мінімальна інгібуюча концентрація (МІК) нового бактеріоцини - 1,5-12 мкг × мл-1, що говорить про високу активність речовини. При цьому такі концентрації ніяк не впливали на людську сироватку, не викликали лізис нейтрофілів або еритроцитів і не інгібували метаболічну активність моноцитів. Бактеріальні ж клітини під дією лугдуніна в концентрації навіть нижче МІК припиняли синтезувати ДНК, РНК, білки і компоненти клітинної стінки. В цьому відношенні лугдунін нагадує даптоміцином, що дає такий же ефект, але спосіб дії якого поки не вивчений. Не було відзначено виникнення резистентності клітин S.aureus до лугдуніну навіть після їх місячного вирощування на малих концентраціях.
Таблиця 1. Спектр активності лугдунінаВиди і штамиРезистентністьМІК лугдуніна (мкг × мл-1)
Staphylococcus aureus USA300 (LAC) MRSA 1,5 + 50% людської сироватки крові 1,5 Staphylococcus aureus USA300 (NRS384) MRSA 1,5 Staphylococcus aureus Mu50 GISA 3 Staphylococcus aureus SA113 3 Staphylococcus aureus RN4220 3 Enterococcus faecium BK463 VRE 3 Enterococcus faecalis VRE366 VRE 12 Listeria monocytogenes ATCC19118 6 Streptococcus pneumoniae ATCC49619 1,5 Bacillus subtilis 168 (trpC2) 4 Pseudomonas aeruginosa PAO1> 50 Escherichia coli DH5α> 50 Умовні позначення : MRSA - метицилін-резистентні S. aureus; GISA - стійкі до глікопротеїну S. aureus; VRE - ванкоміцин-резистентні Enterococcus. Таблиця з [ 1 ].
Випробування в бойових умовах
Як і годиться, здатність лугдуніна лікувати стафілококові інфекції продемонстрували in vivo на мишачої моделі (рис. 5). У шести мишей зголили шерсть на спині і, пошкодивши шкіру багаторазовим приклеюванням / відклеюванням пластиру, нанесли на це місце золотистого стафілокока. Потім шкіру обробили маззю, яка містить 1,5 мкг лугдуніна, і через шість годин оцінили результат. Обробка новим антибіотиком сильно скорочувала або навіть повністю знищувала популяцію S.aureus. Причому не тільки на поверхні шкіри, але і в більш глибоких її шарах.
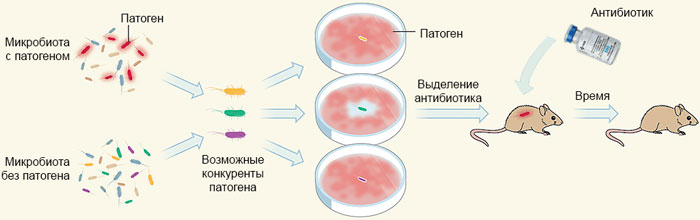
Малюнок 5. Загальна схема підходу до ідентифікації природного антибіотика. З бактеріальних популяцій людського тіла відбирають представників, які не можуть співіснувати з важливими патогенними бактеріями. Цих можливих конкурентів тестують окремо на середовищах з інфекційним агентом. З культури, успішно переважної зростання патогенів, виділяють антибіотик, дія якого перевіряють на тваринних моделях. Малюнок з [5], модифікований і адаптований.
Щоб зрозуміти, чи може S.lugdunensis перешкодити колонізації носової порожнини хребетних тварин золотистим стафілококом в природних умовах, вчені провели наступний експеримент. У носи бавовняних хом'яків ввели два види змішаних культур (S.aureus + S.lugdunensis IVK28 і S.aureus + S.lugdunensis IVK28ΔlugD) і кожну окремо. У контрольних випадках, коли вводили по одному штаму, все три культури стабільно колонізували носову порожнину. Однак при введенні суміші S.aureus + S.lugdunensis IVK28 кількість золотистого стафілокока через 5 днів значно зменшилася в порівнянні з сумішшю S.aureus + S.lugdunensis IVK28ΔlugD. Цей експеримент показав, що продукція лугдуніна дозволяє штаму IVK28 ефективно конкурувати з золотистим стафілококом in vivo.
Залишалося розібратися, запобігає присутність S.lugdunensis в носі людини колонізацію бактеріями S.aureus. Ціпперер і його колеги досліджували мазки з носових ходів 187 госпіталізованих хворих. З них у 60 осіб (32,1%) виявили золотистого стафілокока і у 17 осіб (9,1%) - S.lugdunensis. І тільки у одного пацієнта з S.lugdunensis в носі мешкав S.aureus. У всіх виділених штамів S.lugdunensis ПЛР-аналіз продемонстрував наявність lug-оперона, а всі виявлені штами S.aureus виявилися сприйнятливі до лугдуніну.
перспективи
Через високу ефективність лугдуніна автори обговорюваної роботи пропонують використовувати S.lugdunensis в боротьбі з золотистим стафілококом, особливо у пацієнтів з високими ризиками розвитку інфекції - після операцій, імуносупресії або гемодіалізу. Раніше пробиотическими, як правило, називали бактерій, активно діючих на благо макроорганізму в шлунково-кишковому тракті. Група Ціпперера виступає за розширення поняття «пробіотики» - включення туди бактерій, що борються з інфекціями і в інших місцях людського тіла, таких як носова порожнина або шкіра.
У дуже рідкісних випадках і сам S.lugdunensis може викликати захворювання, але якщо вдасться створити мутантів, повністю втратили фактори вірулентності, або вбудувати lug-оперон в абсолютно «мирні» бактерії, можна розробити безпечний пробіотичний препарат.
Лугдунін оказался дерло Виявлення Бактеріоціні нового класу - макроциклических тиазолидинового пептидних антібіотіків. Всі перевірені штами S.aureus (як природні, так и лабораторні) НЕ змоглі віробіті резістентності до него. Це дає надію на те, що лугдунін в майбутньому стане комерційним препаратом для боротьби з золотистим стафілококом.
І нарешті, сам факт виявлення нового антибіотика у представника людської мікробіоти повинен послужити стимулом для активізації пошуку інших продуцентів бактеріоцинів в складі саме таких спільнот. Надалі це допоможе медикам успішніше стримувати наступ мультирезистентних патогенів.
література
- Zipperer A., Konnerth MC, Laux C., Berscheid A., Janek D., Weidenmaier C. et al. (2016). Human commensals producing a novel antibiotic impair pathogen colonization. Nature. 535, 511-516;
- Dobson A., Cotter PD, Ross RP, Hill C. (2012). Bacteriocin production: a probiotic trait? Appl. Environ. Microbiol. 78, 1-6;
- Donia MS, Cimermancic P., Schulze CJ, Wieland Brown LC, Martin J., Mitreva M. et al. (2014 року). A systematic analysis of biosynthetic gene clusters in the human microbiome reveals a common family of antibiotics. Cell. 158, 1402-1414;
- біомолекул: «Антимікробні пептиди - можлива альтернатива традиційних антибіотиків»;
- Lewis K. and Strandwitz P. (2016). Antibiotics right under our nose. Nature. 535, 501-502;
- Вікіпедія: «Золотистий стафілокок»;
- Карпов И.А. і Качанко Е.Ф. (2005). Стафілококова інфекція: клінічні аспекти та перспективи терапії. Медичні новини. 9, 53-56;
- Mandal A. (2012). What is Staphylococcus aureus? News-Medical.net;
- Naber CK (2009). Staphylococcus aureus bacteremia: epidemiology, pathophysiology, and management strategies. Clin. Infect. Dis. 48, S231-S237;
- Золотистий стафілокок (Staphylococcus aureus). Гастроскан;
- біомолекул: «Мобільні генетичні елементи прокаріотів: стратифікація" суспільства "бродяжок і домосідів»;
- Вікіпедія: «Нерібосомние пептиди»;
- Caboche S., Pupin M., Leclère V., Fontaine A., Jacques P., Kucherov G. (2008). NORINE: a database of nonribosomal peptides. Nucleic Acids Res. 36, D326-D331;
- Mironovskiĭ ML, Ostash BE, Fedorenko VA (2010). Diversity of genes encoding nonribosomal peptide synthetases in the Streptomyces sioyaensis genome. Genetika. 46, 896-903.
Портал «Вічна молодість» http://vechnayamolodost.ru
25.08.2016
What is Staphylococcus aureus?













